某化学活动小组欲用纯碱制取烧碱,做了如下实验:
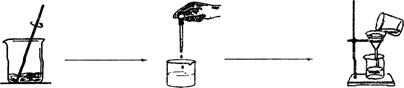
现取20g纯碱样品(假设杂质不溶于水,也不与其他物质反应),向其中加入34.1g水使其完全溶解,然后再加入100g的溶质质量分数为l7.1%的氢氧化钡溶液,至恰好完全反应,过滤得到滤渣和一种不饱和溶液。请回答问题:
(1)上述实验步骤中,请指出操作中的错误 ;
(2)请写出发生反应的化学方程式 ;
(3)列出参加反应固体物质质量(x)的比例式为 ;
(4)求纯碱样品的纯度为 ;
(5)反应后所得溶液的溶质质量分数为 。
(1)过滤时没用玻璃棒引流 (2)Na2CO3+ Ba(OH)2==BaCO3↓+2NaOH
(3) (4)53% (5)6.4%
(4)53% (5)6.4%
题目分析:(1)过滤时玻璃棒的作用是引流;(3)根据化学方程式的计算,比例式为 ;(4)根据(2)问求出参加反应的碳酸钠的质量,为20g纯碱样品中纯净的碳酸钠的质量;(5)根据溶液质量分数的定义,得用溶质质量除以溶液总质量然后乘以百分之百,溶质质量即为反应生成的氢氧化钠的质量,根据(2)中化学方程式可以算出,溶液质量即为20g纯碱样品中纯净的碳酸钠的质量加上34.1g水,再加上100g的溶质质量分数为l7.1%的氢氧化钡溶液的质量,最后减去生成的碳酸钡的质量(根据(2)中化学方程式可以算出)。
;(4)根据(2)问求出参加反应的碳酸钠的质量,为20g纯碱样品中纯净的碳酸钠的质量;(5)根据溶液质量分数的定义,得用溶质质量除以溶液总质量然后乘以百分之百,溶质质量即为反应生成的氢氧化钠的质量,根据(2)中化学方程式可以算出,溶液质量即为20g纯碱样品中纯净的碳酸钠的质量加上34.1g水,再加上100g的溶质质量分数为l7.1%的氢氧化钡溶液的质量,最后减去生成的碳酸钡的质量(根据(2)中化学方程式可以算出)。
点评:这类题目要有层次的做,不要浮躁,属于中考必考题型,注意计算细心。
