课外活动时,同学们采用以下两种方法测定某氯化钠溶液的溶质质量分数。
(1)【化学方法】向一定量氯化钠溶液中加入足量硝酸银溶液,得到2.87g氯化银固体,则该氯化钠溶液中氯化钠的质量为多少?(根据化学方程式列式计算)
经多次实验测定,该溶液的溶质质量分数为10%。
(2)【物理方法】取一定量该溶液进行蒸发,测量实验数据如下:
| 蒸发皿的质量(g) | 25.0 |
| 蒸发皿+食盐溶液(g) | 45.0 |
| 蒸发皿+食盐晶体(g) | 27.4 |
| 数据处理 | 溶液的溶质质量分数为 |
A.蒸发时未用玻璃棒搅拌
B.所取氯化钠溶液质量较大
C.蒸发时出现少量晶体时就停止加热
D.实验后未将玻璃棒上的白色固体移入蒸发皿
(1)1.17g。
(2)12% C
(1)解题思路:已知氯化银的质量,求氯化钠的质量。可根据反应中二者的质量关系进行求解。具体解题过程:
解:设生成氯化钠质量为x 设未知量
NaCl+AgNO3=AgCl↓ +NaNO3 写出反应的化学方程式
58.5 143.5 标出物质的质量比
X 2.8 7g 标出物质的实际质量比
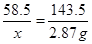 列比例式
列比例式
x=1.17g 求解未知量
答:生成氯化钠质量为1.17g。 写出答案
(2)食盐晶体的质量为:27.4 g-25.0 g="2.4" g
食盐溶液的质量为:45.0 g-25.0 g="20" g
溶液的溶质质量分数为: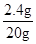 ×100%=12%
×100%=12%
物理方法测定的溶液的溶质质量分数大,说明食盐晶体的质量比实际值偏大。
点评:根据化学方程式的计算要写出反应的化学方程式,找出已知和未知量的关系,明确解题的思路。格式要规范。
