问题
计算题
向10g铜和氧化铜的混合物中逐滴滴入溶质质量分数为9.8%的稀硫酸至恰好完全反应,测得共用去稀硫酸100g,过滤。计算:
(1)原混合物中铜元素的质量为多少克?
(2)过滤后所得溶液的溶质质量分数。
答案
(1) 8.4g (2)14.8%
题目分析:本题难度适中。铜做为不活泼金属不会和稀硫酸反应,氧化铜能与稀硫酸反应生成硫酸铜,题目未告知铜和氧化铜的质量,我们只能依据恰好完全反应从反应的硫酸的质量计算出氧化铜和硫酸铜的质量。必须注意的是(1)提问是铜元素的质量,氧化铜中也含有铜元素质量不可忽视,所以质量为10g-8g+(8*(64/80))g=8.4g;过滤后溶液的溶质为硫酸铜,质量是16g,可溶液质量必须注意,不是100+10=110g,因为原来混合物中铜单质2g没有参与反应,过滤也除去了,所以溶液质量为100+8=108g,因而进一步得到答案是(16g/(100g+8g))*100%=14.8%。
解:稀硫酸中参加反应的硫酸质量为100g×9.8%=9.8g
设:反应产生的CuSO4是xg,反应消耗的CuO为yg.
CuO+ H2SO4 = CuSO4 + H2O
80 98 160
y 9.8g x
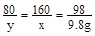
x="16g"
y=8g
10g-8g+(8*(64/80))g=8.4g
(16g/(100g+8g))*100%
= 14.8%
答:铜元素的质量为8.4g ,过滤后所得溶液的溶质质量分数为14.8%
点评:溶液的质量分数一直会是计算的重点。
