已知2A(g)+B(g)⇌2C(g),向容积为1L的密闭容器中加入0.050molA和0.025molB,在500℃时充分反应,达平衡后测得c(C)=0.040mol.L-1,放出热量Q1kJ.
(1)能说明上述反应已经达到化学平衡状态的是______(填字母编号)
a.v(C)=2v(B)
b.单位时间内生成2molA的同时消耗1molB
c.容器内压强保持不变d.容器内气体的密度保持不变
(2)若在相同的容器中只加入0.050molC,500℃时充分反应达平衡后,吸收热量Q2kJ,则Q1与Q2之间的关系式可表示为______(用含Q1、Q2的代数式表示).
(3)500℃时,上述反应的化学平衡常数K=______.
(4)已知K(300℃)>K(350℃),该反应是______(填“放”或“吸”)热反应;若反应温度升高,A的转化率______(填“增大”、“减小”或“不变”).
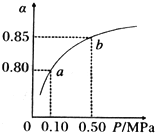
(5)某温度下,A的平衡转化率(a))与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A)______K(B)(填“>”、“<”或“=”.)
(1)a.v(C)=2v(B),不能判断正反应速率和逆反应速率的关系,所以不能说明已经达到平衡状态,故错误;
b.单位时间内生成2mol A为逆速率,消耗1molB为正速率,而且正逆速率之比等于化学计量数之比,所以是平衡状态,故正确;
c.反应后气体的物质的量减小,所以容器内的压强减小,所以容器内压强保持不变,即是平衡状态,故正确;
d.反应后气体的体积不变,气体的质量也不变,所以容器内气体的密度始终保持不变,不能判断平衡状态,故错误;
故答案为:bc;
(2)2A(g)+B(g)⇌2C(g)
起始的量:0.050mol 0.025mol 0
转化的量:x 0.5x x
平衡的量:0.050-x 0.025-0.5x x
已知达平衡后测得c(C)=0.040mol.L-1,所以0.040mol.L-1×1L=x,即x=0.04mol;
若在相同的容器中只加入0.050mol C,把C全部转化为AB时,则生成0.050mol A和0.025mol B,与第一次相等,所以两次的平衡为等效平衡,所以平衡时各物质的量相同;
2C(g)⇌2A(g)+B(g)
起始的量:0.050mol 00
转化的量:y y 0.5y
平衡的量:0.050-y y 0.5y
所以0.04=0.050-y,即y=0.01mol,则
=0.04mol Q1
,所以Q1=4Q2,故答案为:Q1=4Q2;0.01mol Q2
(3)平衡时c(A)=
mol/l=0.01mol/L,c(B)=0.050-0.04 1
mol/L=0.005mol/L,c(C)=0.040mol/L,0.025-0.5×0.040 1
所以K=
=3200L•mol-1;故答案为:3200L•mol-1;c2(C) c2(A)×c(B)
(4)已知K(300℃)>K(350℃),所以温度越高K越小,说明升高温度平衡逆移,所以正反应为放热反应;反应温度升高,平衡逆移,所以A的转化率减小,故答案为:放;减小;
(5)平衡常数只与温度有关,所以平衡状态由a变到b时压强增大,但温度不变,所以K不变,即K(A)=K(B),故答案为:=.
