问题
计算题
某工厂需要280g生石灰(CaO)作干燥剂,需要碳酸钙的质量是多少?至少需要含碳酸钙80%的石灰石(杂质不参加反应)的质量是多少?(CaCO3 CaO+CO2↑)
CaO+CO2↑)
答案
500g;625g.
题目分析:利用化学方程式结合氧化钙的质量可求出碳酸钙的质量;
根据纯物质的质量=含杂质物质的质量×物质的纯度,可求出含杂质的石灰石的质量;
解:设用去的碳酸钙的质量为x,
CaCO3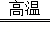 CaO+CO2↑
CaO+CO2↑
100 56
x 280g
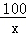 =
=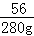
解得:x=500g
所以需要石灰石的质量为:500g÷80%=625g
答:需要碳酸钙的质量是500g;至少需要含碳酸钙80%的石灰石的质量是625g.
