鸡蛋壳的主要成分是碳酸钙。某学生想测定鸡蛋壳中碳酸钙的质量分数,取15g干燥的碎鸡蛋壳放入烧杯中,向其中加入了40g稀盐酸恰好完全反应(假设鸡蛋壳中除碳酸钙外的其他成分都不溶于水,且不与稀盐酸反应),反应后烧杯中物质的总质量50.6g。计算鸡蛋壳中碳酸钙的质量分数(结果保留1位小数)。
66.7%
题目分析:根据质量守恒定律可知,反应前后物质的总质量不变。
反应前物质的总质量为:15g(干燥的碎鸡蛋壳)+40g(稀盐酸)=55g而反应后烧杯中物质的总质量50.6g,这说明反应过程中生成了55g-50.6g=4.4 g的气体。此气体为二氧化碳。因此在反应中知道了二氧化碳的质量为4.4 g,可求出参加反应的碳酸钙的质量。然后再求出碳酸钙在鸡蛋壳中所占的质量分数。
解:生成二氧化碳的质量为:40g+15g-50.6g = 4.4g
设15g鸡蛋壳中碳酸钙的质量为x。
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
100 44
 4.4g
4.4g
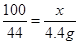
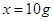
鸡蛋壳中碳酸钙的质量分数为: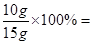 66.7%
66.7%
答:鸡蛋壳中碳酸钙的质量分数为66.7%
