某铜矿石含氧化铜、氧化亚铜、三氧化二铁和大量脉石(SiO2),现采用酸浸法从矿石中提取铜,其流程图如下:
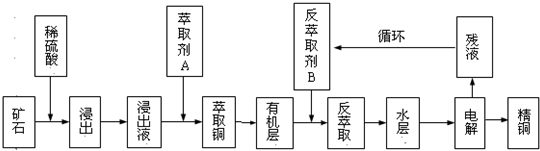
已知:①当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;②反萃取后的水层是硫酸铜溶液,Cu2+浓度约为50g/L.回答下列问题:
(1)矿石用稀硫酸浸出过程中氧化亚铜发生的反应为:Cu2O+2H+═Cu2++Cu+H2O;请写出该过程中发生的另一个氧化还原反应的离子方程式:______.
(2)萃取剂A是一类称作为肟类的有机化合物,如N-510、N-530等.某肟类化合物A的分子结构中仅含n1个-CH3、n2个-OH 和n3个

三种基团,无环状结构,三种基团的数目关系为n3=______.若A的相对分子质量为116,分子结构中碳原子跟碳原子相连接,则A的结构简式是______.
(3)写出电解过程中阳极(惰性电极)发生反应的电极反应式:______.
(4)循环中反萃取剂B的主要成分是______.
(5)某铜矿石样品中,若仅含氧化亚铜、三氧化二铁和脉石三种物质.取该矿石样品200.0g,用100mL1.0mol•L-1H2SO4溶液浸取后,还需加入10mL 1.0mol•L-1 Fe2(SO4)3溶液才能使铜全部浸出,浸取液经充分电解后可得到 6.4gCu.求铜矿石样品中氧化亚铜和氧化铁的质量分数?
(1)矿石用稀硫酸浸出过程中氧化亚铜发生的反应为,Cu2O+2H+═Cu2++Cu+H2O;金属铜和三价铁之间发生氧化还原反应;反应的离子方程式为:Cu+2Fe3+═2Fe2++Cu2+;
故答案为::Cu+2Fe3+═2Fe2++Cu2+;
(2)-CH3、-OH是端头基,
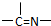
是分子的骨架,一个
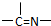
就需多一个端头基,加上链首尾的两个端头基,共需端头基n3+2,即n3+2=n1+n2;n3=n1+n2-2;
依据分析判断出的取代基,若A的相对分子质量为116,分子结构中碳原子跟碳原子相连接,得到结构简式为:CH3-C(=N-OH)-C(=N-OH)-CH3;
故答案为:n1+n2-2;CH3-C(=N-OH)-C(=N-OH)-CH3;
(3)电解过程中阳极(惰性电极)放电的是氢氧根离子失电子生成氧气,发生反应的电极反应式:4OH--4e-═O2↑+2H2O;
故答案为:4OH--4e-═O2↑+2H2O;
(4)反萃取后的水层是硫酸铜溶液,由电解知生成硫酸,所以循环中反萃取剂B是硫酸;
故答案为:H2SO4;
(5)取该矿石样品200.0g,用100mL1.0mol•L-1H2SO4溶液浸取后,还需加入10mL 1.0mol•L-1 Fe2(SO4)3溶液才能使铜全部浸出,浸取液经充分电解后可得到 6.4gCu;
依据铜元素守恒氧化亚铜中的铜元素最后生成铜,铜Cu物质的量=
=0.1mol;氧化亚铜物质的量为0.05mol;质量为0.05mol×144g/mol=7.2g;6.4g 64g/mol
Cu2O%=
×100%=3.6%;依据氧化还原反应电子守恒Fe3+~Cu+~Cu计算得到:n(Fe3+)=0.1mol;原样品中铁元素物质的量为=0.1mol-0.02mol=0.08mol;7.2g 200g
所以Fe2O3物质的量为:0.04mol,质量分数=
×100%=3.2%;0.04mol×160g/mol 200g
故答案为:Cu2O:3.6%; Fe2O3:3.2%;
