为测定某纯碱样品(含少量氯化钠杂质)中碳酸钠的含量,取12g样品放入烧杯中,加入100g稀盐酸,恰好完全反应。经测定,所得溶液常温下为不饱和溶液,其质量为107.6 g(产生的气体全部逸出)。试计算:
(1)反应生成二氧化碳的质量为 g,12g样品中碳酸钠的质量为 g。
(2)稀盐酸中溶质的质量分数(写出计算过程)。
(1)4.4 10.6
(2) 7.3%
题目分析:依据质量守恒定律化学反应前后物质的总质量不变,那么减少的质量为生成二氧化碳的质量;利用化学方程式根据反应的质量即可求出碳酸钠的质量和稀盐酸中溶质的质量。
(1)生成的二氧化碳的质量=12g+100g-107.6g=4.4g
(2)解:设碳酸钠的质量为y,参加反应的H Cl的质量为x。
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 44
Y x 4.4g
73∶44 = x∶4.4g x = 7.3g
106/44=y/4.4g y=10.6g
稀盐酸中溶质的质量分数为: 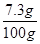 ×100% = 7.3%
×100% = 7.3%
答:稀盐酸中溶质的质量分数为7.3%。
