问题
计算题
(1)配制200g质量分数10%的氯化钠溶液,需要溶质氯化钠的质量为:(列式计算)
= g
(2) 某工厂利用废铁屑和废硫酸起反应来制取回收硫酸亚铁。现有废硫酸19.6吨(H2SO4质量分数为10%),与足量的废铁屑反应,可以生产多少吨硫酸亚铁?(Fe+H2SO4= FeSO4+H2↑)
答案
(1)200g×10%=20g;(2)3.04t
题目分析: (1)根据溶质质量分数的计算公式:溶质质量分数=溶质的质量/溶液质量,那么溶质的质量=溶液的质量×溶质质量分数即可求出;
需要溶质氯化钠的质量= 200g×10%=20g
(2)利用化学方程式硫酸与硫酸亚铁反应的质量比即可计算出硫酸亚铁的质量;
解:设可以生产硫酸亚铁的质量为x。
硫酸的质量为:19.6t×10%=1.96t
Fe+H2SO4= FeSO4+H2↑
98 152
1.96t x
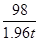 =
=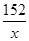
X=3.04t
答:反应生成3.04t的硫酸亚铁。
