问题
计算题
(3分)某碳酸钠样品中含有少量氯化钠。现称量11 g该样品放入烧杯中,然后加入一
定量溶质的质量分数为14.6%的稀盐酸,至恰好完全反应,去除溶液中的水分,最终得
到12.1g氯化钠固体。计算:
(1)碳酸钠样品中碳酸钠的质量
(2)反应后所得溶液中溶质的质量分数。(结果精确到0.1%)
答案
(1)10.6g ;(2) 21.4%
题目分析:解:设碳酸钠的质量为x
Na2CO3 + 2HCl = 2NaCl + H2O + CO2 ↑ ………………………(1分)
106 73 117 44
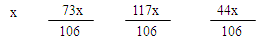
11g - x + 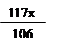 = 12.1 g
= 12.1 g
x =" 10.6" g ………………………(1分)
 |
生成二氧化碳的质量为: ×10.6g = 4.4g
同理,生成氯化钠的质量为:11.7g参加反应的盐酸的质量为: 7.3g
反应后所得溶液中溶质质量分数为: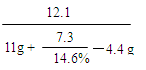 ×100% ≈ 21.4% …(1分)
×100% ≈ 21.4% …(1分)
答:碳酸钠样品中碳酸钠的质量为10.6g , 反应后所得溶液中溶质的质量分数为21.4%
考点:根据化学方程式的计算、有关溶液的计算
