为测定该补血剂样品[主要成分是硫酸亚铁晶体(FeSO4•7H2O)]中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一:用酸性KMnO4溶液滴定测定铁元素的含量
(1)写出滴定反应的离子方程式______.
(2)下列滴定方式中,最合理的是______(夹持部分略去)(填字母序号).

(3)实验前,首先要准确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需______(填仪器名称).
(4)某同学设计以原电池的形式实现Fe2+至Fe3+的转化,电解质溶液为稀硫酸,请写出负极的电极反应式______
方案二 将FeSO4转化为Fe2O3,测定质量变化操作流程如下:
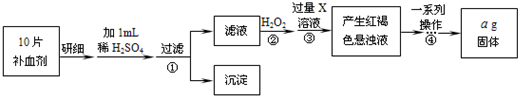
(3)步骤②中除用H2O2外还可以使用的物质是______.
(5)步骤②是否可以省略______,理由是______.
(6)步骤④中一系列操作依次是:过滤、洗涤、______、冷却、称量.
(7)假设实验无损耗,则每片补血剂含铁元素的质量______g(用含a的代数式表示).
方案一:(1)酸性高锰酸钾具有强氧化性,将Fe2+氧化为Fe3+,被还原为Mn2+,同时生成水,反应离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
(2)酸性高锰酸钾具有强氧化性,可以发生橡皮管,应盛放在酸式滴定管内,硫酸亚铁溶液呈酸性,应盛放在酸式滴定管内,故B最合适;
故答案为:B;
(3)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶;
故答案为:250mL容量瓶;
(4)原电池负极反应氧化反应,Fe2+在负极放电生成Fe3+,负极电极反应式为Fe2+-e-═Fe3+;
故答案为:Fe2+-e-═Fe3+;
方案二:
(3)步骤②加入有强氧化性试剂,能将Fe2+全部氧化为Fe3+,除用H2O2外还可以使用氯水等;
故答案为:氯水;
(5)Fe2+与碱反应后不能保证Fe2+全部转化为Fe3+,加热不能得到纯净的Fe2O3,故无法准确计算Fe的含量,故步骤②不能省略;
故答案为:不能,Fe2+与碱反应后不能保证Fe2+全部转化为Fe3+,加热不能得到纯净的Fe2O3,故无法准确计算Fe的含量;
(6)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
故答案为:灼烧;
(7)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量
=0.07ag;ag× 112 160 10
故答案为:0.07a.
