绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.下面是以商品级纯度铁屑(含少量锡等杂质)生产绿矾的一种方法:
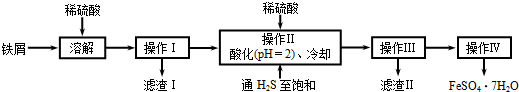
已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.
(1)检验所得绿矾晶体中是否含有Fe3+的实验操作是______.
(2)操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是______;通入硫化氢至饱和的目的是:
①除去操作I所得溶液中含有的Sn2+等杂质离子;
②______.
(3)操作IV的顺序依次为:______、结晶______.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
②______.
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL(滴定时发生反应的离子方程式为:5Fe2++MnO-4+8H+═5Fe3++Mn2++4H2O).
①计算上述样品中FeSO4•7H2O的质量分数为______.
②若用上述方法测定的样品中FeSO4•7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有______;______.
(1)检验所得绿矾晶体中是否含有Fe3+的实验操作是利用三价铁离子检验方法分析,三价铁离子遇硫氰酸根离子会反应生成硫氰酸铁血红色,证明铁离子的存在,
故答案为:取少量晶体溶于水,滴加KSCN溶液,若不出现血红色,表明不含有Fe3+;
(2)已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是,在溶液PH=2时,Sn2+完全沉淀,亚铁离子不沉淀,通入硫化氢至饱和的目的是:硫化氢具有强还原性,可以防止亚铁离子被氧化,
故答案为:使Sn2+完全变成SnS沉淀,而Fe2+不沉淀;防止Fe2+的氧化;
(3)溶液中得到晶体,需要对溶液进行加热蒸发浓缩,结晶析出,过滤洗涤等,所以操作IV的顺序依次为:蒸发、结晶、过滤、洗涤,故答案为:蒸发、过滤洗涤;
(4)冰水温度低,物质溶解度减小,可以洗去沉淀表面的杂质离子,避免绿矾溶解带来的损失,
故答案为:降低洗涤过程中FeSO4•7H2O的损耗;
(5)①a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL;依据反应方程式减小计算:
5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5 1
n(Fe2+) 0.01000mol/L×0.0200L
计算得到;n(Fe2+)=0.001mol;
则250mL溶液中含Fe2+=0.001mol×
=0.01mol;250 25
FeSO4•7H2O物质的量为0.01mol,质量=0.01mol×278g/mol=2.78g;
质量分数=
×100%=97.54%;2.78g 2.85g
故答案为:97.54%;
②用上述方法测定的样品中FeSO4•7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因是洗涤不彻底,亚铁离子被空气中的氧气部分氧化,
故答案为:样品中存在少量的杂质(如H2O、H2SO4等);样品部分被氧化.
