某研究性学习小组为探究某医药公司出品的液体补血剂中的铁元素,进行了如下实验:
I.向试管中加入液体补铁剂2mL,加入蒸馏水,振荡后发现溶液变澄清透明;滴加KSCN溶液,溶液显示淡红色.学生甲认为此补血剂含铁量很低,属不合格产品.
(1)你认为学生甲的观点合理吗?______
II.学生乙认为还应进一步探究实验,他将学生甲所得溶液分成三份,分别加入了氯水、溴水、碘水.发现加入氯水、溴水后溶液呈血红色,颜色明显加深,加入碘水的试管颜色无明显变化.请回答下列问题:
(2)根据乙的上述实验说明补血剂中的铁为______价.
(3)向补血剂溶液中滴加KSCN溶液,显示淡红色的原因______.
(4)请写出加入氯水后对应的离子反应方程式______.
(5)请根据乙同学的实验现象进一步推断,氯、溴的单质可将铁单质氧化成______价铁,而Fe与I2反应的产物应该是______.
III.学生丙也做了与学生甲同样的实验,将所得的淡红色溶液分成两份继续进行实验:
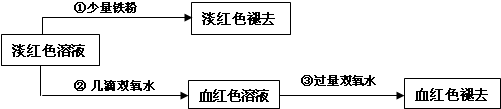
试回答下列问题:
(6)请写出丙的实验①中淡红色褪去的离子方程式______.
(7)关于③中的实验现象,丙同学提出了假设:过量的双氧水将SCN-氧化了.请你设计一个实验方案验证丙的假设______.
(1)因补血剂的成分是Fe2+,滴加KSCN溶液,溶液显示淡红色,说明Fe3+的浓度低,故答案为:不合理;
(2)因加入氯水、溴水后溶液呈血红色,颜色明显加深,说明生成更多的Fe3+,而Fe2+能氧化剂如氯气、液溴所氧化,则原溶液中铁的化合价为+2价,故答案为:+2;
(3)因Fe2+氧化生成Fe3+,Fe3+遇SCN-变红,所以向补血剂溶液中滴加KSCN溶液,显示淡红色的原因有少量的亚铁离子被氧化,故答案为:有少量的亚铁离子被氧化;
(4)因Fe2+与Cl2反应生成Fe3+和Cl-:Cl2+2Fe2+=2Cl-+2Fe3+,故答案为:Cl2+2Fe2+=2Cl-+2Fe3+;
(5)根据加入氯水、溴水后溶液呈血红色,颜色明显加深,说明生成更多的Fe3+;加入碘水的试管颜色无明显变化,说明Fe2+与I2不反应;故答案为:+3,FeI2;
(6)根据Fe3+检验方法,溶液中继续加入过量KSCN溶液,若溶液变红则说明是过量的双氧水将SCN-氧化了,故答案为:
取少量加入过量双氧水后的溶液,往其中加入过量KSCN溶液,若溶液变红则说明是过量的双氧水将SCN-氧化了.
