问题
计算题
为测定一种复合氧化物型的磁性粉末材料的组成,称取12.52 g样品,将其全部溶于过量稀硝酸后,配成100 mL溶液,取其一半加入过量的K2SO4溶液生成白色沉淀。经过滤、洗涤、烘干后得4.66 g固体。在余下的50 mL溶液中加入少许KSCN溶液,显红色;如果加入过量NaOH溶液,则生成红褐色沉淀,将沉淀过滤、洗涤、灼烧后得3.2 g固体。
(1)计算磁性材料中氧元素的质量分数。
(2)确定材料的化学式。
答案
(1)20.45%
(2)BaFe2O4
n(BaSO4)=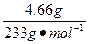 ="0.02" mol,
="0.02" mol,
n(Fe2O3)= ="0.02" mol
="0.02" mol
则m(Ba)="0.02" mol×137 g·mol-1="2.74" g
m(Fe)="0.02" mol×2×56 g·mol-1="2.24" g
则m(O)="12.52" g-(2.74 g+2.24 g)×2="2.56" g
n(O)= ="0.16" mol
="0.16" mol
w(O)=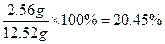
n(O)∶n(Ba)∶n(Fe)=0.16∶0.04∶0.08=4∶1∶2
所以,该氧化物化学式为:BaFe2O4
