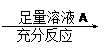 为了测定一定质量的铜铝混合物中铜的质量分数,某化学课外活动小组设计了如下两个方案:
为了测定一定质量的铜铝混合物中铜的质量分数,某化学课外活动小组设计了如下两个方案:
方案Ⅰ:铜铝混合物 测定生成气体的体积
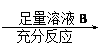 |
方案Ⅱ:铜铝混合物 测定剩余固体的质量
回答下列问题:
⑴小组成员一致认为两个方案都可行,你认为在实验室中选择方案 更便于实施。
⑵小组成员一致认为两个方案中可供选择的溶液A和B有很多,你认为在两个方案中溶液A和B均可选用的是 。(填编号)
A.稀盐酸 B.氢氧化钠溶液 C.硫酸铜溶液
⑶小组成员为探究Cu2+、Al3+在溶液中是否可以依次转化为沉淀而析出,设计了如下实验:向含有0.01molHNO3、0.001molCu(NO3)2、0.045molAl(NO3)3的溶液中逐滴加入一定浓度的NH3H2O溶液,使混合溶液的PH值不断升高,当加至溶液的体积为45mL时Al3+开始反应生成成沉淀,当加至溶液的体积为50mL时Cu2+开始反应生成沉淀。(不考虑溶液的体积变化)
【查阅资料】:常温下Ksp[Al(OH)3]=1.0×10-33mol·L-4,Ksp[Cu(OH)2]=2.0×10-20mol·L-3。
①Al(OH)3开始析出时溶液的PH值?
②若溶液中离子的浓度约为1.0×10-5 mol·L-时可视为沉淀完全,则当Al(OH)3沉淀完全时Cu(OH)2是否析出?
⑴Ⅱ
⑵AB
⑶①(计算到)c(OH-)=1.0×10-11mol·L-,PH=3
②(计算到)PH=5,Cu(OH)2开始析出
(计算到)PH≈4.7,Al(OH)3沉淀完全
Al(OH)3沉淀完全时,无Cu(OH)2析出。
(1)在中学实验条件下测质量比测气体体积所受的干扰少,精度较高。
(2)易判断,CuSO4溶液与铝会发生置换反应,生成铜单质,这样测出的铜就不是原有的铜了。
(3)根据Ksp[Al(OH)3] = c3(OH-).c(Al3+)即可算出c(OH-)从而算出PH.=3
根据Ksp[Cu(OH)2]=2.0×10-20mol·L-3,c(Cu2+) 已知 ,可算出PH=5时,Cu(OH)2开始析出
根据Ksp[Al(OH)3] = c3(OH-), c(Al3+)=1.0×10-5 mol·L-可算出PH≈4.7,Al(OH)3沉淀完全,所以Al(OH)3沉淀完全时,无Cu(OH)2析出。
