问题
选择题
两种金属粉末的混合物15 g,投入足量的稀盐酸中,得到5.6 L氢气(标准状况),则这种混合物可能是( )
A.镁和铁
B.镁和铝
C.铁和锌
D.钠和镁
答案
答案:C
金属粉末投入足量的稀盐酸中,放出氢气,金属失电子,酸中的氢离子(H+)得电子。由氧化还原反应的规律知,金属失电子总数等于氢离子(H+)得电子总数,推知:15 g金属混合物失电子的物质的量为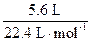 ×2="0.5" mol,金属混合物的平均摩尔电子质量为15 g/0.5 mol="30" g· mol-1。所列选项的金属的摩尔电子质量分别为:镁,24 g/2 mol="12" g· mol-1;铁,56 g/2 mol="28" g· mol-1;铝,27g/3 mol="9" g· mol-1;锌,65 g/2 mol="32.5" g· mol-1;钠,23 g· mol-1,由平均值定理可知,铁和锌符合题意。
×2="0.5" mol,金属混合物的平均摩尔电子质量为15 g/0.5 mol="30" g· mol-1。所列选项的金属的摩尔电子质量分别为:镁,24 g/2 mol="12" g· mol-1;铁,56 g/2 mol="28" g· mol-1;铝,27g/3 mol="9" g· mol-1;锌,65 g/2 mol="32.5" g· mol-1;钠,23 g· mol-1,由平均值定理可知,铁和锌符合题意。
