为测定某铜银合金的成分,将30.0g合金溶于80mL13.5mol/L的浓HNO3中,将合金完全溶解后,收集到气体6.72L(标准状况),并测得溶液的pH=0,假设反应后溶液的体积仍为80mL,试计算:
(1)被还原的HNO3的物质的量。
(2)合金中Ag的质量分数。
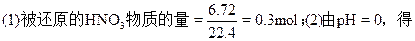
[H+]=1mol/L。
所以,参加反应的HNO3总物质的量=(13.5-1)×0.08=1mol。
设:合金含Agxg,含Cu(30-x)g则
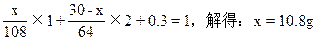
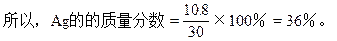
本题解题关键在于把握Cu,Ag与浓HNO3反应过程中,隐含了浓HNO3稀释的计算实质,即所涉及的反应有四个:
Ag+2HNO3(浓)====AgNO3+NO2↑+H2O (1)
Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O (2)
3Ag+HNO3(稀)====3AgNO3+NO↑+2H2O (3)
3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O (4)
采取对反应体系的始态与终态进行整体分析,利用守恒法则可获得十分简捷的计算。
观察四个化学方程式,不难看出:被还原的HNO3均转化成NO和NO2,根据N原子数守恒分析,被还原的硝酸的物质的量等于NO与NO2物质的量之和。从已知的NO与NO2的总体积进而可求得被还原的HNO3的量。
从HNO3的作用分析:消耗HNO3的总物质的量等于被还原HNO3与只起酸性作用的HNO3物质的量之和。由化学式AgNO3和Cu(NO3)2,可将只做酸用的HNO3量以Ag和Cu的物质的量代换,即:
n(HNO3)====n(NO+NO2)+n(Ag)+2n(Cu)
据此可简捷地求得Ag的质量分数。
