问题
填空题
(12分)某同学用10 mol/L的浓盐酸配制250mL 1 mol/L的稀盐酸,并进行有关实验。请回答下列问题:
(1)需要量取浓盐酸 mL。
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有 、 等。
(3)取所配制的稀盐酸100mL,与一定质量的锌充分反应,锌全部溶解后,生成的气体在标准状况下的体积为0.896L,则参加反应的锌的质量为 g ;设反应后溶液的体积仍为100 mL ,则反应后溶液中H+的物质的量浓度为 。
答案
(1)25 (2)250mL容量瓶 胶头滴管 (3)2.6、0.2 mol/L
(1)稀释过程中,溶质的物质的量不会更改,即:10×V=1×0.25,得V=0.025L,即25ml
(2)配制溶液最主要的仪器为一定规格的容量瓶;在定容中,需要用到胶头滴管
(3)100mL稀盐酸中溶质的物质的量为0.1mol,产生的氢气的物质的量为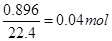 ,由反应Zn+2HCl=ZnCl2+H2↑可知,参加反应的锌的质量为0.04×65=2.6g,消耗的盐酸的物质的量为0.08mol,溶液中还剩余HCl为0.02mol,其中H+的物质的量浓度为
,由反应Zn+2HCl=ZnCl2+H2↑可知,参加反应的锌的质量为0.04×65=2.6g,消耗的盐酸的物质的量为0.08mol,溶液中还剩余HCl为0.02mol,其中H+的物质的量浓度为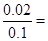 0.2 mol/L
0.2 mol/L
