在500g稀硝酸中投入48g铁粉,若两种物质恰好完全反应(还原产物为NO)。求:
(1)稀HNO3的质量分数?
(2)被还原的硝酸的物质的量?
(1)若铁不过量,则生成物为Fe(NO3)3
设HNO3的质量为x
Fe + 4HNO3====Fe(NO3)3+NO↑+2H2O
56g 252g
48g x
x=(252g×48g)/56g=216g
HNO3的质量分数=216g/500g×100%=43.2%

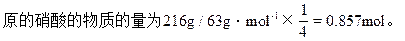
(2)若铁过量,Fe(NO3)3全部被还原,则生成物为Fe(NO3)2。
设HNO3的质量为y
3Fe + 8HNO3====3Fe(NO3)2+2NO↑+4H2O
168g 504g
48g y
y=(504q×48g)/168g=144g
HNO3的质量分数=144g/500g×100=28.8%
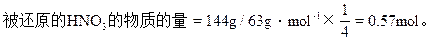
因此硝酸的质量分数为28.8%≤HNO3%≤43.2%
被还原的硝酸的物质的量为0.57mol≤被还原的HNO3的物质的量≤0.857mol。
本题考查了学生的审题能力。本题看上去简单,实际上很复杂。这是因为硝酸与铁反应时,两者相对量的不同,最终生成物也不一样。若铁与硝酸适量完全反应,则生成Fe(NO3)3;若铁过量,则生成的Fe(NO3)3要与铁反应,而最终生成Fe(NO3)2,第一种情况,消耗硝酸较多,第二种情况消耗的硝酸的量较少(因为铁的质量一定)。若消耗的硝酸的量介于两者之间,即过量不多,则生成和中既有Fe(NO3)2,又有Fe(NO3)3。因此,本题计算的结果不是确定值,而是在一定的范围内,故可分两种情况讨论。
