问题
计算题
将12.8克由CuSO4和Fe组成的固体,加入足量的水中充分反应后,滤出固体,干燥后称得5.2克。求原混合物中CuSO4和Fe各为多少克?
答案
CuSO4为8克,Fe为4.8克
此题有三种反应可能:恰好完全反应、CuSO4过量、Fe过量。
余下固体有两可能:(1)余下Fe和Cu;(2)余下全是Cu.
(1)当余下固体是Fe和Cu(即Fe过量)时,设x克CuSO4耗尽,则铁为(12.8-x)克,置换差量为5.2-(12.8-x)克。
CuSO4 + Fe 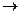 FeSO4 +Cu 固体增重
FeSO4 +Cu 固体增重
160 56 64 64-56=8(理论差量)
x 5.2-(12.8 -x)(实际差量)
-x)(实际差量)
160:x=8:[5.2-(12.8-x)]
∴ x=8(克),12.8-x=4.8(克)。
(2)设余下固体全是Cu,反应时有w克Fe耗尽。
CuSO4 + Fe 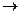 FeSO4+ Cu 固体增重
FeSO4+ Cu 固体增重
56 64 64-56=8(理论差量)
 W 5.2-w(实际差量)
W 5.2-w(实际差量)
56:w=8:5.2-w
∴ w=4.55(克),
则原混合物中CuSO4为12.8-4.55=8.25(克)。
而8.25克CuSO4中只含8.25×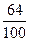 =3.3(克)Cu,故不可能有5.2克Cu生成。由此可见(2)的假设不成立。
=3.3(克)Cu,故不可能有5.2克Cu生成。由此可见(2)的假设不成立。
