某校化学研究性学习小组在学习了金属的知识后,探究Cu的常见化合物性质。过程如下:
提出猜想
① 在周期表中,Cu、Al位置接近。Cu不如Al活泼,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
② 常况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?
③ CuO有氧化性,能被H2、CO等还原,也能被氮的气态氢化物还原吗?
实验探究
⑴ 解决问题①需用到的药品有CuSO4溶液、 (填试剂),同时进行相关实验。
⑵ 解决问题②的实验步骤和现象如下:取一定量的Cu(OH)2固体,加热至80 ℃~100 ℃时,得到黑色固体粉末,继续加热到1000 ℃以上,黑色粉末全部变成红色粉末氧化亚铜。向氧化亚铜中加入过量稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。根据以上现象写出氧化亚铜和稀硫酸反应的离子方程式 。
⑶为解决问题③,设计了如下的实验装置(夹持装置未画出):
在实验中观察到CuO变成红色物质,无水CuSO4变成蓝色,生成物中还有一种无污染的单质气体Y。现有氮的某种气态氢化物X气体0. 0l mol,缓缓通过红热的氧化铜玻璃管完全反应后,测得C装置增重0. 36g并收集到单质气体Y0.28g。
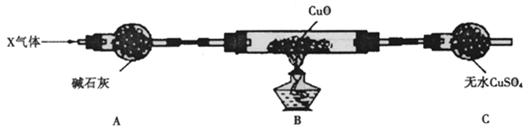
X气体的摩尔质量 ,B中发生反应的化学方程式为 。
(4)请猜测用上述装置测量时有可能产生误差的原因
. (答1条即可)
实验结论
⑴Cu(OH)2具有两性。证明Cu(OH)2具有两性的实验现象是
. 。
⑵ 根据实验方案⑵,得出的+1价Cu和+2价Cu稳定性大小的结论是:
.
⑶ CuO能够被氮的气态氢化物还原。
实验探究
⑴ H2SO4(HCl)溶液、浓NaOH溶液 ………………………………1分
⑵Cu2O + 2H+ ="==" Cu + Cu2+ + H2O…1分
 |
(3)32g/mol (1分) N2H4 + 2CuO 2Cu + N2 +2 H2O 1分
(4)①外界空气中的水蒸气进入C中;②B中水蒸气残留,故产生的水蒸气不能完全被C装置吸收;③产生的水蒸气流速过快未被C装置完全吸收。④N2H4不能完全与CuO反应(其他合理答案也可以)(2分)
实验结论
⑴ Cu(OH)2既能溶于盐酸,又能溶于浓NaOH溶液 …………………………2分
⑵高于1000℃时Cu2O比CuO稳定,在酸性溶液中Cu2+比Cu+稳定
(其他合理答案也可以)(2分).
