将3.96g组成为X2YZ4的盐(不是复盐)溶于水,滴加适量稀硫酸后再加入2.24g还原铁粉,恰好完全反应生成Fe2+。向反应后的溶液中加入足量的KOH溶液至刚好将Fe2+完全沉淀;将沉淀过滤、洗涤并充分加热后得到红棕色固体4.80g;将滤液在一定条件下蒸发可得到一种纯净的不含结晶水的含氧酸盐(不是复盐)13.92g。
(1)红棕色固体的化学式为______________,含氧酸盐的化学式为______________。
(2)组成为X2YZ4的盐中是否含有铁元素和钾元素?通过计算说明。
(3)推断X2YZ4的盐的化学式,写出推断过程。
(1)(2分)Fe2O3,K2SO4。
(2)(2分)加入的铁粉物质的量为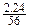 =0.04(mol),而4.8gFe2O3中含铁的物质的量为
=0.04(mol),而4.8gFe2O3中含铁的物质的量为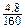 ×2=0.06(mol),0.06>0.04,故X2YZ4的盐中含有铁元素。
×2=0.06(mol),0.06>0.04,故X2YZ4的盐中含有铁元素。
13.92g K2SO4中K+的物质的量为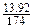 ×2=0.16(mol),而沉淀Fe2+所用KOH的物质的量为0.06×2=0.12(mol),0.16>0.12,故X2YZ4的盐中含有钾元素。
×2=0.16(mol),而沉淀Fe2+所用KOH的物质的量为0.06×2=0.12(mol),0.16>0.12,故X2YZ4的盐中含有钾元素。
(3)(6分)已知X2YZ4是盐,且含有铁元素和钾元素,故其中必定有一种非金属元素且为负价。n(K) ∶n(Fe)=0.04∶0.02=2∶1
①若X为Fe、Z为K,由于K呈+1价,当Fe的化合价≥+2时,Y的化合价≤-8,不合理。
②若X为K、Y为Fe,则Z为非金属且在化学式中呈负价。
盐X2YZ4的摩尔质量为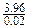 =198(g/mol),故Z的相对原子质量为16,即Z为氧元素,所以盐X2YZ4的化学式为K2FeO4。
=198(g/mol),故Z的相对原子质量为16,即Z为氧元素,所以盐X2YZ4的化学式为K2FeO4。
