常温下,在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应。
(1)铁粉与水蒸气反应的化学方程式是:
(2)停止反应,待装置冷却后,取出反应过的铁粉混合物,加入过量的稀硫酸充分反应。过滤。简述检验所得滤液中Fe3+的操作方法:
(3)经检验上述滤液中不含Fe3+,这不能说明铁粉与水蒸气反应所得产物中不含+3价的铁。原因是(结合化学方程式说明):
(4)某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色。
①沉淀由白色变为红褐色的化学方程式是:
②为了得到白色的Fe(OH)2沉淀,并尽可能使沉淀长时间保持白色,有人设计如下图所示的装置:
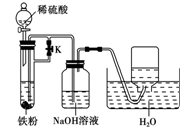
请简述实验操作及原理:
(1) 3Fe+4H2O(g) Fe3O4+4H2↑
Fe3O4+4H2↑
(2)取少量溶液于试管中,滴入几滴KSCN溶液,观察溶液颜色。如果溶液颜色变为血红色,说明溶液中含有Fe3+,否则不含Fe3+
(3)如果反应后的铁粉混合物中铁粉过量,可发生反应:Fe+Fe2(SO4)3===3FeSO4,铁粉将溶液中的Fe3+全部还原为Fe2+,即便加入KSCN溶液也不变血红色
(4) ① 4Fe(OH)2+O2+2H2O===4Fe(OH)3
②实验时,先打开活塞K,再将分液漏斗中的旋塞打开,使稀硫酸与铁粉作用,用产生的H2排出装置中的空气;然后关闭K,使生成的H2将试管中的FeSO4溶液压入NaOH溶液中,则可在盛NaOH溶液的试剂瓶中较长时间观察到生成的白色Fe(OH)2沉淀
本题考查铁及其化合的重点知识点,属于对相关知识理解记忆后直接应用,比较容易。
(1)注意产物是Fe3O4, 3Fe+4H2O(g) Fe3O4+4H2↑
Fe3O4+4H2↑
(2)Fe3+的检验:取少量溶液于试管中,滴入几滴KSCN溶液,观察溶液颜色。如果溶液颜色变为血红色,说明溶液中含有Fe3+,否则不含Fe3+
(3)如果反应后的铁粉混合物中铁粉过量,可发生反应:Fe+Fe2(SO4)3===3FeSO4,铁粉将溶液中的Fe3+全部还原为Fe2+,即便加入KSCN溶液也不变血红色
(4) ① 4Fe(OH)2+O2+2H2O===4Fe(OH)3
②实验时,先打开活塞K,再将分液漏斗中的旋塞打开,使稀硫酸与铁粉作用,用产生的H2排出装置中的空气;然后关闭K,使生成的H2将试管中的FeSO4溶液压入NaOH溶液中,则可在盛NaOH溶液的试剂瓶中较长时间观察到生成的白色Fe(OH)2沉淀
