向盛有a g镁铝合金的烧杯中加入cl mol/L稀硫酸V1L,合金完全溶解后,再加入c2mol/L的NaOH溶液V2L,生成沉淀的质量恰好达到最大值bg。则下列关系式不正确的是( )
A.2c1V1=c2V2
B.反应产生氢气的质量m(H2)= 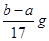
C.b≤a+17c2V2
D.合金中含镁的质量分数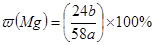
答案:D
分析:A、加入氢氧化钠溶液后,沉淀达到最大值,说明镁离子和铝离子都生成了沉淀,溶液中的溶质为硫酸钠,所以2n(Na+)=n(SO42-),2c1V1=c2V2,
B、根据镁、铝与硫酸后再与氢氧化钠的化学方程式,可得到关系式:2Al~3H2~2Al(OH)3,Mg~H2~Mg(OH)2,n(H2)= 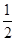 n(OH-),产生氢气的质量=
n(OH-),产生氢气的质量= 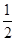 ×
× 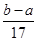 ×2=
×2= 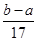 g;
g;
C、沉淀质量=合金质量+合金离子结合氢氧根离子的质量,当硫酸与合金恰好完全反应时,b=a+17c2V2,当硫酸有剩余时,b<a+17c2V2;
D、假设镁的质量为xg,则铝的质量为(a-x)g,由关系式2Al~2Al(OH)3,Mg~Mg(OH)2,求出x,进而求出镁的质量分数.
解:镁铝合金中加入硫酸、再加入氢氧化钠溶液,发生化学反应:2Al+3H2SO4═Al2(SO4)3+H2↑,Mg+H2SO4═MgSO4+H2↑,Al2(SO4)3+3NaOH═2Al(OH)3+Na2SO4,若硫酸过量,加入氢氧化钠后,首先发生反应,H2SO4+2NaOH═Na2SO4+H2O.
A、加入氢氧化钠溶液后,沉淀达到最大值,说明镁离子和铝离子都生成了沉淀,溶液中的溶质为硫酸钠,所以2n(Na+)=n(SO42-),根据原子守恒n(Na+)=n(NaOH)=c2V2,
n(SO42-)=n(H2SO4)=c1V1,所以2c1V1=c2V2,故A正确.
B、根据镁、铝与硫酸后再与氢氧化钠的化学方程式,可得到关系式:2Al~3H2~2Al(OH)3,Mg~H2~Mg(OH)2,
n(H2)=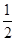 n(OH-),n(OH-)=
n(OH-),n(OH-)=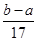 mol,产生氢气的质量=
mol,产生氢气的质量=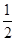 ×
×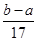 ×2=
×2=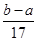 g;故B正确;
g;故B正确;
C、因为沉淀质量=合金质量+合金离子结合氢氧根离子的质量,当硫酸与合金恰好完全反应时,氢氧化钠完全与铝离子和镁离子反应,合金离子结合氢氧根离子的质量=17c2V2g,当硫酸有剩余时,合金离子结合氢氧根离子的质量<17c2V2;所以b≤a+17c2V2;故C正确.
D、假设镁的质量为xg,则铝的质量为(a-x)g,
由关系式Al~Al(OH)3,Mg~Mg(OH)2,
27 78 24 58
a-x x
可知氢氧化铝的质量=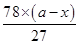 g
g
氢氧化镁的质量=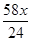 g,
g,
有沉淀总质量为bg,所以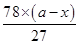 +
+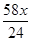 =b,解之得:x=
=b,解之得:x=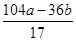 g
g
所以合金中镁的质量分数=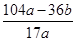 ×100%,故D错误.
×100%,故D错误.
故选D.
