工业上采用硫化钠-石灰铁盐法处理高砷废水(砷的主要存在形式为H3AsO3)取得了很好的效果.实现了废水处理过程的“三废”零排放.其主要工艺流程如下:
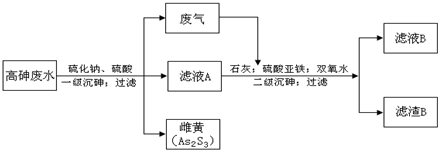
已知:①亚砷酸(H3AsO3)还原性较强,易被氧化为砷酸(H3AsO4)
②亚砷酸盐的溶解性大于相应的砷酸盐[如Ksp(FeAsO3)>Ksp(FeAsO4)]
请回答以下问题:
(1)废气的主要成分为______,通过与石灰发生______反应(填基本反应类型)被吸收.
(2)写出一级沉砷过程中生成雌黄的离子方程式:______.
(3)滤液A中,除了有Na2SO4、H2SO4以外,还有溶质______.
(4)二级沉砷过程中使用双氧水的目的有______.
A.将三价砷氧化为五价砷,以提高除砷效果
B.将Fe2+氧化可生成Fe(OH) 3沉淀,以加速悬浮物的沉降
C.作绿色氧化剂,不引进新的杂质
(5)过滤操作常用的玻璃仪器有:______
(6)滤渣B的主要成分有______(写两种,用化学式表示).
(1)在废水中加入硫化钠和硫酸,发生:S2-+2H+=H2S↑,H2S为酸性气体,与碱发生中和反应或复分解反应,
故答案为:H2S;中和反应(或复分解反应);
(2)反应物为H3AsO3、硫化钠和硫酸,生成物为As2S3,则反应的离子方程式为2H3AsO3+3S2-+6H+=As2S3↓+6H2O或 2H3AsO3+3S2-=As2S3↓+6OH-;H++OH-=H2O,
故答案为:2H3AsO3+3S2-+6H+=As2S3↓+6H2O(或 2H3AsO3+3S2-=As2S3↓+6OH-;H++OH-=H2O);
(3)当硫化钠不足,硫酸过量时,还可能有为反应的H3AsO3,故答案为:H3AsO3;
(4)双氧水具有氧化性,为绿色氧化剂,能将三价砷氧化为五价砷,易于生成FeAsO4沉淀而除去,将Fe2+氧化可生成Fe(OH) 3沉淀,以加速悬浮物的沉降,故答案为:A B C;
(5)过滤时用到的仪器有铁架台、玻璃棒、漏斗、滤纸以及烧杯,其中玻璃仪器有漏斗、烧杯、玻璃棒,
故答案为:漏斗、烧杯、玻璃棒;
(6)加入双氧水,可将三价砷氧化为五价砷,将Fe2+氧化可生成Fe3+,由于亚砷酸盐的溶解性大于相应的砷酸盐,
可生成FeAsO4、Ca3(AsO4)2、Fe(OH) 3、CaSO4、还可能存在少量Ca3(AsO3)2,
故答案为:FeAsO4、Ca3(AsO4)2、Ca3(AsO3)2、Fe(OH) 3、CaSO4等.
