在一体积为10L的容器中,通入一定量的CO和H2O,在85℃时发生如下反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-Q kJ/mol CO和H2O浓度变化如图,则
(1)0-4min的平均反应速率v(CO)=______mol/(L•min)
(2)下列能说明反应达到平衡状态的是______.
a、每消耗1mol CO2的同时生成l molH2O b、体系压强保持不变
c、v正(CO)=v逆(CO2) d、容器中混合气体的密度保持不变
e、混合气体中H2O的体积分数保持不变 f、CO2和H2的体积比保持不变
t1℃时物质浓度(mol/L)的变化
| 时间 | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
①表中3min-4min之间反应处于______状态;C1数值______0.08mol/L(填大于、小于或等于).
②反应在4min-5min之间,平衡向逆方向移动,可能的原因是______(单选),表中5min-6min之间数值发生变化,可能的原因是______(单选).
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度.
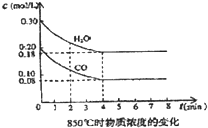
(1)v(CO)=
=△C △t
=0.03mol/L.min,故答案为:0.03mol/L.min;(0.20-0.08)mol/L 4min
(2)a、无论反应是否达到平衡状态,每消耗1mol CO2的同时生成l molH2O,所以不能作为判断平衡的依据,故错误;
b、该反应是一个反应前后气体体积不变的可逆反应,无论反应是否达到平衡状态,体系压强始终保持不变,所以不能作为判断平衡的依据,故错误;
c、当v正(CO)=v逆(CO2)时,该反应达到平衡状态,所以可以作为判断平衡的依据,故正确;
d、反应前后气体的质量不变,容器的体积不变,所以气体的密度始终不变,所以容器中混合气体的密度保持不变不能作为判断平衡的依据,故错误;
e、反应达到平衡状态时,各物质的体积不变,所以混合气体中H2O的体积分数保持不变可以作为判断平衡的依据,故正确;
f、无论反应是否达到平衡状态,CO2和H2的体积比可能都保持不变,这与反应起始浓度和转化率有关,所以不能作为判断平衡的依据,故错误;
故选ce;
(3)①3min、4min时,各物质的物质的量浓度不变,所以该反应达到平衡状态;
该CO(g)+H2O(g)⇌CO2(g)+H2(g)反应是放热反应,升高温度,平衡向逆反应方向移动,所以t℃(高于850℃)时,C1数值大于850℃CO的浓度,所以C1>0.08mol/L,
故答案为:平衡;>;
②C1>0.08mol/L,则C3<0.12mol/L,C2>0.18mol/L,4min-5min之间,平衡向逆方向移动,二氧化碳的浓度降低,一氧化碳和水蒸气的浓度都增大,所以改变的条件是增大氢气的浓度;
5min-6min之间,一氧化碳浓度减小,水蒸气和二氧化碳浓度增大,平衡向正反应方向移动,则改变的条件是增大水蒸气的浓度;
故答案为:d;a.
