( I)在2L密闭容器中,800℃时反应2NO(g)+O2(g)⇌2NO2(g)体系中,n(NO)随时间的交化如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
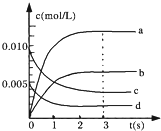
(2)如图中表示NO2的变化的曲线是______,用O2的浓度变化表示从0~2s内该反应的平均速率v=______;
(3)能说明该反应已经达到平衡状态的是______
a. v(NO2)=2v(O2);b.容器内压强保持不变;c.v逆(NO)=2v正(O2);d.容器内物质的密度保持不变.
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是______
a.及时分离出NO2气体;b.适当升高温度;c.增大O2的浓度;d.选择高效的催化剂.
( II)用石墨做电极电①稀H2SO4 ②K2SO4溶液 ③CuCl2溶液 ④CuSO4 溶液 ⑤KOH溶液.
(1)阴阳极都有气体产生,且体积比(相同条件下)为2:1的是______(填序号,下同),其阳极的电极反应式都是______,总反应的化学方程式是______.
(2)阴极.阳极都有气体产生,其中溶液的pH变小的是______,pH变大的是______.
(3)一个电极析出金属,一个电极析出气体,且溶液pH明显减小的是______,其总反应的化学方程式是______.
(Ⅰ)、(1)可逆反应2NO(g)+O2(g)⇌2NO2(g)的平衡常数k=
;c2(NO2) c2(NO)•c(O2)
平衡常数K(300℃)>K(350℃),说明温度升高,平衡向逆反应移动,升高温度平衡向吸热反应移动,故该反应正反应是放热反应.
故答案为:
;放热.c2(NO2) c2(NO)•c(O2)
(2)NO2是产物,随反应进行浓度增大,平衡时c(NO2)为NO浓度的变化量△c(NO),由表中数据可知3s时反应达平衡,平衡是n(NO)=0.007mol,△n(NO)=0.02mol-0.007mol=0.013mol,故c(NO2)=△c(NO)=
=0.0065mol/L,所以图中表示NO2变化的曲线是b;0.13mol 2L
2s内用NO表示的平均反应速率v(NO)=
=3.0×10-3mol•L-1•s-1,速率之比等于化学计量数之比,0.02mol-0.008mol 2L 2s
所以v(O2)=
v(NO)=1 2
×3.0×10-3mol•L-1•s-1=1.5×10-3mol•L-1•s-1.1 2
故答案为:b;1.5×10-3mol•L-1•s-1;
(3)a、表示同一方向反应速率,v(NO2)自始至终为v(O2)的2倍,不能说明达到平衡,故a错误;
b、随反应进行,反应混合气体总的物质的量在减小,压强减小,当压强不变,说明反应到达平衡,故b正确;
c、不同物质表示速率,到达平衡时,正逆速率之比等于化学计量数之比,V逆 (NO):正(O2)=2:1,即V逆 (NO)=2v正(O2),故c正确;
d、混合气体的总质量不变,容器容积为定值,所以密度自始至终不变,不能说明达到平衡,故d错误.
故答案为:bc.
(4)可逆反应2NO(g)+O2(g)⇌2NO2(g)正反应是体积减小的放热反应.
a.及时分离出NO2气体,瞬间逆反应速率减小,正反应速率不变,平衡向正反应进行,随后反应混合物各组分的浓度降低,速率减小,故a错误;
b.升高温度反应速率增大,平衡向吸热反应移动,即平衡向逆反应移动,故b错误;
c.增大O2的浓度,瞬间正反应速率增大,逆反应速率不变,平衡向正反应进行,随后生成物的浓度增大,逆反应速速率增大,故c正确;
d.加入高效催化剂,同等程度增大正、逆反应速率,平衡不移动,故d错误.
故选:c.
(Ⅱ)、(1)由给出电解质溶液可知,阴阳极都有气体产生,且体积比(相同条件下)为2:1的,实质是电解的水生成氧气与氢气,电解质溶液应为:①稀H2SO4、②K2SO4溶液、⑤KOH溶液.电解池的阳极发生氧化反应,氢氧根在阳极放电,生成氧气与水,阳极电极反应式4OH--4e-=O2↑+2H2O;
总反应的化学方程式是2H2O
2H2↑+O2↑. 电解 .
故答案为:①②⑤;4OH--4e-=O2↑+2H2O;2H2O
2H2↑+O2↑. 电解 .
(2)由给出电解质溶液可知,阴阳极都有气体产生,实质是电解的水生成氧气与氢气,电解质溶液应为:①稀H2SO4、②K2SO4溶液、⑤KOH溶液.电解后溶液的浓度增大,①稀H2SO4电解后溶液的酸性增强,溶液PH值不变,②K2SO4溶液是中性溶液,电解后溶液PH值不变,⑤KOH溶液电解后溶液的碱性增强,溶液PH值增大.
故答案为:①;⑤.
(3)一个电极析出金属,一个电极析出气体,且溶液pH明显减小,电解质的是④CuSO4溶液符合,电解硫酸铜溶液生成铜、氧气与硫酸,总反应的化学方程式为2CuSO4+2H2O
2Cu+O2↑+2H2SO4. 电解 .
故答案为:④;2CuSO4+2H2O
2Cu+O2↑+2H2SO4. 电解 .
