(8分)黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8∶7;将m g X粉末全部溶于200 mL的浓HNO3,反应后的溶液加水稀至 2.12 L时测得其pH=0;将稀释后的溶液分为两等份,向其中一份溶液中滴加浓度为6. 05 mol/L的NaOH溶液,向另一份溶液中滴加0.600 mol/LBa(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶
05 mol/L的NaOH溶液,向另一份溶液中滴加0.600 mol/LBa(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶 液的体积变化如下图所示:
液的体积变化如下图所示:
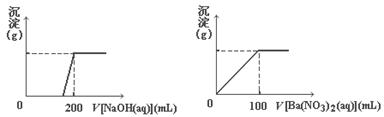
(1)请通过计算确定:m=________。
(2)X的摩尔质量为368 g/mol,则X的化学式为________________。
(3)将一定质量的Fe、Cu的混合物平均分成四等份,每份13.2 g,分别加入同浓度的稀硝酸 ,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO):
,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO):
| 实验编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属质量/g | 9.0 | 4.8 | 0 | 0 |
| NO体积/L | 1.12 | 2.24 | 3.36 | V |
①写出实验①中发生反应的离子方程式___________________________________。
②实验④中V=________。
(8分)
(1)解:依题意,m g X中:n(Cu)∶n(F e)=1∶1
e)=1∶1
2n(Cu2+)+3n(Fe3+)=6.05mol·L-1×0.2 L×2-1 mol·L-1×2.12 L
故:n(Cu)=n(Fe)=0.06 mol
又,n (S)=0.6 mol·L-1×0.1 L×2 = 0.12 mol
因此:m g=m(Cu)+m(Fe)+m(S)=0.06 mol×64g·mol-1+0.06 mol×56 g·mol-1+0.12 mol×32 g·mol-1=11.04 g( 即m 的值为11.04)
(2)解:设X的化学式为(CuFeS2)n,则 (64+56+32×2)×n =3 68,n=2;故X的化学式为Cu2Fe2S4
68,n=2;故X的化学式为Cu2Fe2S4
(3)① 3Fe+8H++2NO3—=3Fe2++2NO↑+4H2O ② V=4.48 L
