[2012·潍坊一模] (14分)黄铜矿的主要成分是CuFeS2,是工业炼铜的主要原料。已知黄铜矿在空气中焙烧生成Cu、FeS和SO2,FeS+2HCl=FeCl2+H2S↑,H2S是一种剧毒气体。某科研小组设计以黄铜矿为原料制取单质铜和氯化铁晶体(FeCl3·6H2O)的流程如下:
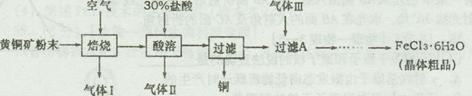
(1)92gCuFeS2在空气中焙烧生成Cu、FeS和SO2转移电子的物质的量为 。
(2)请简述检验气体Ⅰ的操作步骤 。
(3)在实验室中,欲用38%(密度为1.18g·mL-1)的盐酸配制30%的盐酸,需要的玻璃仪器主要有 。
(4)气体Ⅲ最好选用 (填写序号),其主要作用是 。
A.O2
B.H2
C.Cl2
D.N2欲选用下列仪器在实验室中制取纯净干燥的该气体。
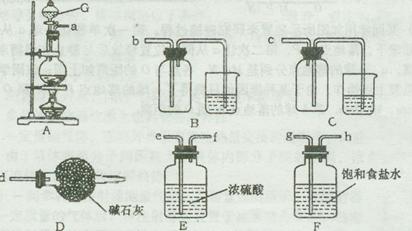
装置A中发生反应的离子方程式为 。
选用合适装置导管口的连接顺序为a接 。图中仪器G的名称是 ;在使用该仪器时,应首先 。
(14分)(1)3mol
(2)收集适量气体Ⅰ通入品红溶液中,溶液褪色,加热溶液恢复红色
(3)玻璃棒、烧杯、量筒
(4)C 把Fe2+氧化成Fe3+ MnO2+4H++2Cl- MnCl2+Cl2↑+2H2O ghefb 分液漏斗 检验其是否漏水
MnCl2+Cl2↑+2H2O ghefb 分液漏斗 检验其是否漏水
(1)n(CuFeS2)=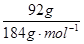 =0.5mol, CuFeS2(Cu、Fe、S的化合价分别为+2、+2和–2价)在空气中焙烧生成Cu、FeS和SO2的化学方程式为CuFeS2+O2
=0.5mol, CuFeS2(Cu、Fe、S的化合价分别为+2、+2和–2价)在空气中焙烧生成Cu、FeS和SO2的化学方程式为CuFeS2+O2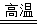 Cu+FeS+SO2↑,分析化学方程式知,1mol CuFeS2参加反应转移6mol电子,故0.5mol CuFeS2参加反应转移3mol电子。
Cu+FeS+SO2↑,分析化学方程式知,1mol CuFeS2参加反应转移6mol电子,故0.5mol CuFeS2参加反应转移3mol电子。
(2)根据题给信息,黄铜矿焙烧生成的气体Ⅰ是SO2,检验SO2的方法是将气体通入品红溶液中,溶液褪色,加热溶液恢复红色。
(3)用溶液配制一定质量分数的溶液,要用到的玻璃仪器有量筒、烧杯和玻璃棒。
(4)气体Ⅲ的作用是将FeCl2氧化成FeCl3,故最好选用Cl2;实验室中用MnO2和浓盐酸在加热条件下制取Cl2,反应的离子方程式为MnO2+4H++2Cl- MnCl2+Cl2↑+2H2O。从导气管口a处流出的气体除Cl2外,还含有杂质气体HCl和水蒸气,应首先用装置F除HCl气体,然后用装置E除水蒸气,最后选择装置B用向上排空气法收集Cl2,故导气管口的连接顺序为ghefb。仪器G是分液漏斗,使用该仪器时要检验是否漏水。
MnCl2+Cl2↑+2H2O。从导气管口a处流出的气体除Cl2外,还含有杂质气体HCl和水蒸气,应首先用装置F除HCl气体,然后用装置E除水蒸气,最后选择装置B用向上排空气法收集Cl2,故导气管口的连接顺序为ghefb。仪器G是分液漏斗,使用该仪器时要检验是否漏水。
