(1)将水蒸气通过红热的焦炭即可产生水煤气,反应为:C(s)+H2O(g)⇌CO(g)+H2(g)一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列不能判断该反应达到化学平衡状态的是______(填字母,下同).
a.容器中的压强不变
b.1molH-H键断裂的同时断裂2molH-O键
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)⇌CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②该反应为______(填“吸热”或“放热”)反应
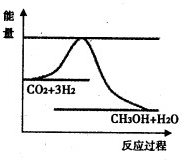
(3)如图表示反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,下列措施中能使cCH3OH)增大的是______.
a.升高温度
b.充入H2(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1molCO2和3molH2.
(1)a.反应前后气体的体积不变,无论是否达到平衡状态,容器中的压强都不变,故a正确;
b.1molH-H键断裂的同时断裂2molH-O键,说明正逆反应速率相等,达到平衡状态,故b错误;
c.v正(CO)=v逆(H2O),说明正逆反应速率相等,反应达到平衡状态,故c错误;
d.c(CO)=c(H2)不能确定反应是否达到平衡状态,平衡时各物质的浓度取决于反应物的配料比和转化的程度,故d正确,
故答案为:a、d;
(2)①)①v(CO2)=v(CO)=
=0.16mol•(L•min)-1,4mol-2.4mol 2L 5min
故答案为:0.16mol•(L•min)-1;
②根据CO(g)+H2O(g)⇌CO2(g)+H2(g)可知压强对平衡移动无影响,如果在650℃,H2O、CO的物质的量改为1mol、2mol,达到平衡时CO的物质的量应为1.2mol,而900℃时CO的物质的量应为1.6mol,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,
故答案是:放热;
(3)a.升高温度平衡向逆反应方向移动,CH3OH减小,故a错误;
b.充入He(g),使体系压强增大,但平衡没有移动,故b错误;
c.将H2O(g)从体系中分离出来,平衡向正反应方向移动,CH3OH浓度增大,故c正确;
d.再充入1mol CO2和3mol H2,平衡向正反应方向移动,CH3OH浓度增大,故d正确.
故答案为:c、d.
