金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)
(1)写出铜溶解于上述混合液的离子方程式____________________________.
(2)若铜完全溶解时,溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶解铜的质量是______g,溶液中的c(SO)=______mol/L.
(3)若欲在如图所示的装置中发生(1)中的反应,请判断图中的正、负极,并选出适当的物质作电极,写出电极反应式,填在相应的表格中.
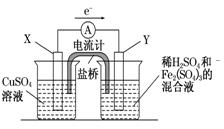
| 正、负极判断 | 电极材料 | 电极反应式 | |
| X极 | |||
| Y极 |
(1)Cu+2Fe3+===Cu2++2Fe2+
(2)0.64 0.5
(3)
| 正、负极判断 | 电极材料 | 电极反应式 | |
| X极 | 负极 | 铜 | Cu-2e-===Cu2+ |
| Y极 | 正极 | 碳 | 2Fe3++2e-===2Fe2+ |
考查知识点:离子反应;电化学基础;
解答过程:(1)混合液中存在H2SO4和Fe2(SO4)3,铜为不活泼金属,不与H2SO4反应;但Fe3+具有氧化性,可将铜单质氧化为铜离子:Cu+2Fe3+===Cu2++2Fe2+ 。
(2)pH=1,则c(H+)=0.1mol/L;则c(Cu2+)=c(H+)=0.1mol/L;则反应生成的铜离子的物质的量为n(Cu2+)=0.1mol/L×100×10—3L="0.01mol" 。
设反应消耗的铜、Fe3+的物质的量为a、b
Cu+2Fe3+===Cu2++2Fe2+
1 2 1
a b 0.01mol
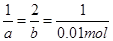 a=0.01mol; b=0.02mol
a=0.01mol; b=0.02mol
则溶解铜的质量m=n·M=0.01mol×64g/mol="0.064g" ;原溶液中Fe3+的浓度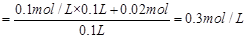 ,根据溶液中正负电荷守恒,可得
,根据溶液中正负电荷守恒,可得
c(H+)+3c(Fe3+)=2c(SO),则SO的浓度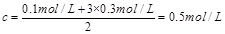
(3)此题主要考查电化学基础,对于电极材料的选择,必须能够导电。由图中电子的移动方向X流向Y,而负极失去电子,故X为负极,发生氧化反应,故其电极材料为铜棒,发生的反应为Cu-2e-===Cu2+;其正极材料为碳棒或石墨,发生反应为:2Fe3++2e-===2Fe2+。
试题点评:本题结合离子反应综合考查了电化学基础以及离子浓度的相关计算,属于中等难度的题目。解题的关键在于熟练的掌握基本的知识点,如“溶液中正负电荷总数相等”、“原电池中,负极失去电子,发生氧化反应;正极得到电子,发生还原反应”、“原电池中电子由负极经导线流向正极”。
