问题
计算题
反应2SO2(g)+O2(g)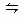 2SO3(g),在一定条件下达到平衡,SO2的起始浓度为8mol/L,O2的起始浓度为2mol/L,SO2的平衡转化率为25%,求平衡时反应混合物中SO3的体积分数。若将O2的起始浓度加大至4mol/L,SO2的起始浓度不变,平衡时测得SO3的浓度为2.8mol/L,求SO2、O2各自的转化率。
2SO3(g),在一定条件下达到平衡,SO2的起始浓度为8mol/L,O2的起始浓度为2mol/L,SO2的平衡转化率为25%,求平衡时反应混合物中SO3的体积分数。若将O2的起始浓度加大至4mol/L,SO2的起始浓度不变,平衡时测得SO3的浓度为2.8mol/L,求SO2、O2各自的转化率。
答案
⑴SO3的体积分数为:22.2%;⑵SO2、O2的转化率均为35%。
⑴设O2的消耗浓度为x,则:
2SO2(g)+O2(g)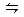 2SO3(g)
2SO3(g)
初始浓度/mol/L: 8 2 0
转化浓度/mol/L: 2x x 2x
平衡浓度/mol/L: 8—2x 2—x 2x
依题意,可得:
K=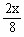 ×100%=25% 解得:x=1 mol·L-1
×100%=25% 解得:x=1 mol·L-1
故SO3的体积分数为: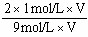 ×100%=22.2%
×100%=22.2%
⑵设O2的消耗浓度为y,则:
2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
初始浓度/mol/L: 8 4 0
转化浓度/mol/L: 2y y 2y
平衡浓度/mol/L: 8—2y 4—y 2y
依题意,可得:2y = 2.8mol/L
解得:y=1.4 mol/L
所以,SO2的转化率为: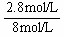 ×100%=35%
×100%=35%
O2的转化率为: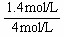 ×100%=35%
×100%=35%
