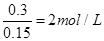问题
计算题
将Fe2O3溶于150mL稀H2SO4中,待Fe2O3完全溶解后,加入铁粉,产生气体3.36L(标准状况),溶液中不再有Fe和Fe3+。已知加入的铁粉和氧化铁共19.2g,计算:
(1)Fe2O3的质量为 g ;
(2)稀H2SO4物质的量浓度为 。
答案
Fe2O3:8g(2分); c(H2SO4) ≥2mol/L(2分)
设铁粉、Fe2O3的物质的量分别为x、y
两物质的总质量:56x+160y=19.2
在反应过程中,最后所得溶液为FeSO4溶液,由电子的得失守恒可得:2x=2y+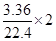
解得x=0.2mol y=0.05mol
故Fe2O3的质量为0.05×160=8g
由硫元素的守恒可知,硫酸溶液中n(H2SO4)≥0.2+0.05×2=0.3mol,故c(H2SO4)≥