(10分)蛇纹石是一种含水的富镁硅酸盐矿物的总称,可以看作由MgO、Fe2O3、Al2O3、SiO2组成。实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 3.3 | 9.4 |
| 完全沉淀的pH | 3.7 | 5.2 | 11.0 |
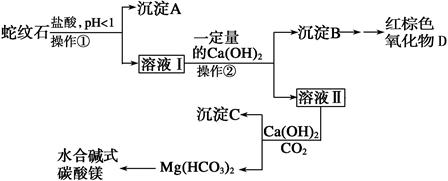
⑴实验室完成操作①所用到的玻璃仪器有:_______________________________。
⑵操作②中应控制溶液pH的合理范围是___________(填序号)。
A. 小于1.5 B. 1.5~3.3 C. 7~8 D. 大于9.4
⑶检验溶液Ⅱ中是否含有Fe3+的操作与结论是:_____________________________________
⑷从沉淀混合物B中制取D,应加入一种试剂进行分离,其反应的离子方程式为:_______________________________,再进行____________、洗涤、___________(依次填写实验操作名称)。
⑴玻璃棒、漏斗、烧杯 (2分) ⑵ C(2分)
⑶取少量溶液Ⅱ于试管中,加入KSCN溶液,若无明显现象,说明溶液Ⅱ不含Fe3+;若溶液变红色,说明溶液Ⅱ含有Fe3+。 (2分)
⑷ OH-+Al(OH)3 = AlO2-+2H2O (2分) 过滤、加热或灼烧(2分,每个1分)
(1)操作①是过滤,所以需要的玻璃仪器是玻璃棒、漏斗、烧杯。
(2)操作②的目的是沉淀铁离子和铝离子,但不能沉淀镁离子,所以根据沉淀的pH可知,应控制溶液pH的合理范围是7~8,答案选C。
(3)检验铁离子的试剂是KSCN溶液,即取少量溶液Ⅱ于试管中,加入KSCN溶液,若无明显现象,说明溶液Ⅱ不含Fe3+;若溶液变红色,说明溶液Ⅱ含有Fe3+。
(4)B中沉淀是氢氧化铝和氢氧化铁,由于氢氧化铝是两性氢氧化物,所以得到氢氧化铁的方法是加入氢氧化钠溶液,过滤即可,反应的离子方程式是OH-+Al(OH)3 = AlO2-+2H2O;由于在氢氧化铁表面有吸附的离子,所以在过滤之后还需要洗涤,最后加热或灼烧。
