(15分)铁和铁的化合物在工业生产和日常生活中都有广泛的用途,请回答下列问题:
(1)铁元素在周期表中的位置是 。
(2)写出Fe与稀硫酸反应的离子方程式 。
(3)已知:Fe2O3(s)+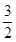 C(s)=
C(s)=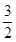 CO2(g)+2Fe(s);△H=+234.1kJ/mol
CO2(g)+2Fe(s);△H=+234.1kJ/mol
C(s)+O2(g)=CO2(g); △H=-393.5kJ/mol.
请写出Fe(s)与O2(g)反应生成Fe2O3(s)的热化学方程式 。
(4)在一定条件下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g)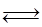 2Fe(s)+3CO2(g);工业上有16 t Fe2O3在200m3的容器中反应,l小时后测得Fe2O3的转化率为50%,则这段时间内CO的消耗速率为 mol/(L·h).
2Fe(s)+3CO2(g);工业上有16 t Fe2O3在200m3的容器中反应,l小时后测得Fe2O3的转化率为50%,则这段时间内CO的消耗速率为 mol/(L·h).
(5)爱迪生蓄电池的反应式为:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2;高铁酸钠( Na2FeO4)是一种新型饮水消毒剂.用题29图装置可以制取少量高铁酸钠.
Fe(OH)2+Ni(OH)2;高铁酸钠( Na2FeO4)是一种新型饮水消毒剂.用题29图装置可以制取少量高铁酸钠.
①此装置中爱迪生蓄电池的负极是____(填“a”或"b”).
②写出阳极的电极反应式________.
③当制得132.8g高铁酸钠时,阳极区减少的阴离子的物质的量为 .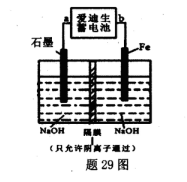
(1)第四周期,Ⅷ族(2分)
(2)Fe+2H+= Fe2++H2↑(2分)
(3)2Fe(s)+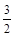 O2(g) = Fe2O3(s) △H=-824.4kJ/mol(3分)
O2(g) = Fe2O3(s) △H=-824.4kJ/mol(3分)
(4)0.75(2分)
(5)①a(1分)
②Fe-6e-+8OH-=FeO42-+4H2O(3分) ③0.8mol(2分)
(1)铁的原子序数是26,位于第四周期,Ⅷ族。
(2)铁和稀硫酸反应生成硫酸亚铁和氢气,方程式为Fe+2H+= Fe2++H2↑。
(3)考查盖斯定律的应用。根据已知反应可知②×2/3-①即得到2Fe(s)+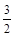 O2(g) = Fe2O3(s) ,所以反应热是-393.5kJ/mol×3/2-234.1kJ/mol=-824.4kJ/mol.
O2(g) = Fe2O3(s) ,所以反应热是-393.5kJ/mol×3/2-234.1kJ/mol=-824.4kJ/mol.
(4)l小时后测得Fe2O3的转化率为50%,则消耗氧化铁是8t,因此消耗CO是
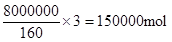 ,所以其反应速率是
,所以其反应速率是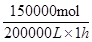 =0.75mol/(L·h)。
=0.75mol/(L·h)。
(5)①制取高铁酸钠,则铁应该是阳极,所以a是负极,b是正极。
②电解池中阳极失去电子,根据氧化产物是高铁酸钠可知,阳极电极反应式为Fe-6e-+8OH-=FeO42-+4H2O。
③132.8g高铁酸钠是132.8g÷166g/mol=0.8mol,所以根据方程式2H2O+Fe+2OH- FeO42-+3H2↑可知,消耗1.6molOH-,但同时生成0.8molFeO42-,所以结束阴离子是0.8mol。
FeO42-+3H2↑可知,消耗1.6molOH-,但同时生成0.8molFeO42-,所以结束阴离子是0.8mol。
