.(8分)草酸亚铁晶体(FeC2O4·2H2O)常用作分析试剂及显影剂等。下图是将一定质量的草酸亚铁在氩气氛围中进行热重分析的示意图(TG%表示残留固体质量占原样品质量的百分数)。请回答下列问题:

(1)B处残留物的化学式为 。C处残留物的化学式为 。
(2)A→C整个反应过程中总反应的化学方程式为 。
(3)上述FeC2O4·2H2O在氩气气氛中进行热重分析的原因是 。
若将分解得到的600℃时的固体与足量的浓硫酸反应后,将溶液浓缩、冷却,有带9个结晶水的晶体析出,该晶体的化学式为 。
(4)现取1.44gFeC2O4放在某真空的密闭容器中,再充入0.04molCO,加热至1100℃,其中反应:FeO(s) + CO(g) 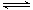 Fe(s) + CO2(g)的平衡常数K=1/3,则反应达平衡时FeO的转化率为 。
Fe(s) + CO2(g)的平衡常数K=1/3,则反应达平衡时FeO的转化率为 。
(1)Fe2C2O4 FeO (2) Fe2C2O4·2H2O FeO+CO↑+CO2↑+2H2O
(3)防止FeC2O4在加热过程中被空气中的氧气氧化。 Fe2(SO4)3·9H2O (4)50%
A→B段为FeC2O4·2H2O生成FeC2O4和水的过程;B→60%段为FeC2O4生成FeCO3和CO过程;60%→C段为FeCO3生成FeO和CO2的过程;所以
(1)B处残留物的化学式为Fe2C2O4;C处残留物的化学式为FeO;
(2)A→C整个反应过程中总反应的化学方程式为:Fe2C2O4·2H2O==FeO+CO↑+CO2↑+2H2O;
(3)FeC2O4·2H2O在氩气气氛中进行热重分析的原因是:防止FeC2O4在加热过程中被空气中的氧气氧化。
(4)由可逆反应过程“三段法”(起始物质的量、变化物质的量、平衡物质的量)可得,反应达平衡时FeO的转化率为50%;
