如图,将一块金属放在盛稀盐酸的反应器中,反应发生一定时间后在装置D处加热,稍后可见装置E中的白色无水硫酸铜粉末变蓝.
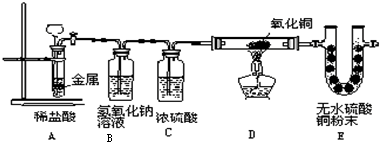
试回答下列问题:
(1)E中白色的无水硫酸铜变蓝,说明D中反应物有______,写出E中变化的化学方程式______.
(2)从E中的变化证明装置A一定有______生成.
(3)写出装置D中发生反应的化学方程式______.
(4)A中反应发生的前提是______.
(5)B装置的作用是______C装置的作用是______.
(1)因为硫酸铜可与水结合生成五水硫酸铜而使固体变蓝,所以可证明D装置内生成了水,其方程式为:CuSO4+5H2O=CuSO4?5H2O;
(2)从氧化铜与气体反应生成水可知:通入的气体必是氢气,因为氢气与氧化铜反应会生成水;
(3)D装置中发生的反应是氢气还原氧化铜,其方程式为:H2+CuO
Cu+H2O; △ .
(4)根据金属活动性顺序表的相关应用可知只有金属的活动性排在氢的前面的金属,才能和盐酸反应生成氢气;
(5)依据氢氧化钠可与盐酸发生中和反应可知B装置的作用是除掉生成气体中可能混有盐酸溶液挥发出的氯化氢气体,浓硫酸是常用的干燥剂,所以此处C装置的作用是干燥氢气.
故答案为::(1)水;CuSO4+5H2O=CuSO4?5H2O;
(2)氢气;
(3)H2+CuO
Cu+H2O; △ .
(4)金属的活动性必须排在氢的前面;
(5)除掉生成气体中可能混有的氯化氢气体;干燥氢气.
