问题
选择题
铁的氧化物可用于脱除煤气中的H2S,有关反应原理如下( )
①Fe3O4(s)+3H2S(g)+H2(g)⇌3FeS(s)+4H2O(g)
②Fe2O3(s)+2H2S(g)+H2(g)⇌2FeS(s)+3H2O(g)
③FeO(s)+H2S(g)⇌FeS(s)+H2O(g)
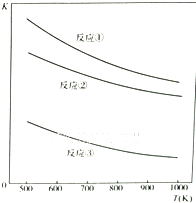
温度与上述各反应的平衡常数的关系如图所示.下列有关说法正确的是( )
A.反应①、②、③中铁的氧化物都是氧化剂
B.反应①、②、③的正反应都是放热反应
C.反应①、②、③中,温度越高H2S的脱除率越高
D.反应①、②、③中,压强越大H2S脱除率越高
答案
A.根据化合价判断,①、②中铁的氧化物都是氧化剂、③中各元素化合价均无变化,不是氧化剂,故A错误;
B.根据图象可知,反应①、②、③升温平衡常数都减小,说明升温平衡左移,则反应①、②、③正反应都是放热反应,故B正确;
C.反应①、②、③中升温平衡常数都减小,说明升温平衡左移H2S的脱除率降低,故C错误;
D.反应①、②、③都是气体体积增大的反应,增大压强平衡左移,H2S脱除率降低,故D错误;
故选B.
