问题
计算题
(6分)现有一种铜和铁的混合物样品。为测定该样品中铁的含量,某学生取10.0 g此样品置于烧瓶中,将80.0 mL稀硫酸分四次加入烧瓶并做相关记录。
有关数据记录如下表:
| 加硫酸的序号 | 加入硫酸的体积/mL | 剩余固体的质量/g |
| 1 | 20.0 | 7.20 |
| 2 | 20.0 | 4.40 |
| 3 | 20.0 | 2.00 |
| 4 | 20.0 | 2.00 |
(1)此样品中铁的质量分数。
(2)所用硫酸溶液溶质的物质的量浓度。
答案
(1)80% (2)2.5mol/L
题目分析:(1)根据表中数据可知,最后剩余铜2 g,则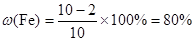
(2) Fe + H2SO4 =" Fe" SO4 + H2↑
56g 1mol
2.8g c(H2SO4)×0.02L
所用硫酸溶液溶质的物质的量浓度c (H2SO4)=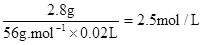
点评:本题主要考查学生的分析能力,很简单基础。


 A.438.34
A.438.34