2L容积不变的密闭容器中,加入1.0molA和2.2molB,进行如下反应:
A(g)+2B(g)⇌C(g)+D(g),
在不同温度下,D的物质的量n(D)和时间t的关系如图
试回答下列问题:
(1)800℃时.0-5min内,以B表示的平均反应速率为______.
(2)能判断该反应达到化学平衡状态的标志是______.
A.容器压强不变B.混合气体中c(A)不变
C.2v正(B)=v逆(D)D.c(A)=c(C)
E.混合气体的平均分子量不再改变F.混合气体密度不变
G.A:B:C:D=1:2:1:1
(3)利用图中数据计算800℃时的平衡常数K=______,B的平衡转化率为:______.
该反应为______反应(填吸热或放热).
(4)800℃时,另一2L容积不变的密闭容器中,测得某时刻各物质的量如下:
n(A)=2.2mol,n(B)=5.2mol,n(C)=1.8mol,n(D)=1.8mol,则此时该反应______进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”).
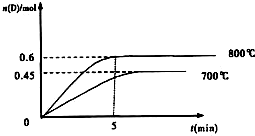
(1)800℃时.0-5min内,D的平均化学反应速率v(D)=
=△n V △t
=0.06mol/Lmin,同一反应中,各物质的反应速率之比等于计量数之比,所以v(B):v(D)=2:1=v(B):0.06mol/Lmin,v(B)=0.12mol•L-1•min-1;0.6mol 2L 5min
故答案为:0.12mol•L-1•min-1;
(2)该反应是反应前后气体体积减小的反应,反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化;
A:该反应是反应前后气体体积减小的反应,当压强不变时,各物质的浓度不再发生变化,故A正确.
B、反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,故B正确;
C、2v正(B)=v逆(D),速率之比不等于化学计量数之比,反应未达平衡状态,故C错误.
D、无论反应是否达到平衡状态,c(A)=c(C),所以不能作为判断平衡状态的依据,故D错误.
E、反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量不变,混合物的质量不变,所以混合气体的平均分子量不再改变,所以能作为化学平衡状态的判断依据,故E正确.
F、根据质量守恒,无论反应是否达平衡状态,混合物质量不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为化学平衡状态的判断依据,故F错误.
G、反应按照n(A):n(B):n(C):n(D)=1:2:1:1进行,开始n(A):n(B)不是1:2;到达平衡后,n(A):n(B):n(C):n(D)一定不是1:2:1:1,故G错误.
故答案为:ABE
(3)A(g)+2B(g) C(g)+D(g),
C(g)+D(g),
起始 1.0mol 2.2mol 0 0
反应0.6mol1.2mol 0.6mol0.6mol
平衡0.4mol 1.0mol 0.6mol0.6mol
平衡时A、B、C、D各物质的浓度分别为0.2mol/L、0.5mol/L、0.3mol/L、0.3mol/l、
化学平衡常数K=
=1.8(mol•L-1)-1;0.3mol/L×0.3mol/L 0.2mol/L×(0.5mol/L)2
B的平衡转化率=
×100%=54.5%;1.2mol 2.2mol
根据图象知,降低温度,D的含量减少,所以平衡向逆反应方向移动,故正反应是吸热反应.
故答案为:1.8(mol•L-1)-1;54.5%;吸热.
(4)A、B、C、D各物质的浓度分别为1.1 mol/L、2.6 mol/L、0.9 mol/L、0.9 mol/L
浓度商QC=
=0.11(mol•L-1)-1<1.8(mol•L-1)-1,所以反应向正反应方向进行.0.9mol/L×0.9mol/L 1.1mol/L×(2.6mol/L)2
故答案为:向正反应方向.
