将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)待产生的气体全部释放后,向溶液加入VmL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol/L。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水
g。
(1)5.8 5.4 (2) (av.10-3+0.5)/0.14 (3)57.67
题目分析:铜与一定浓度的硝酸反应所涉及的化学方程式为:
Cu+4HNO3(浓)=Cu(NO3)2+2H2O+NO2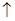 ;3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO
;3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO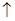
(1)设NO的体积为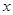 L,则NO2的体积为
L,则NO2的体积为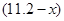 L,由上述方程式可知①与稀硝酸反应的铜的质量为
L,由上述方程式可知①与稀硝酸反应的铜的质量为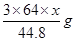 ;②与浓硝酸反应的铜的质量为
;②与浓硝酸反应的铜的质量为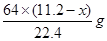 。因此可得如下等式:
。因此可得如下等式: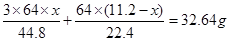 ,解得
,解得 。因此NO的体积为5.8L;NO2的体积为5.4L。
。因此NO的体积为5.8L;NO2的体积为5.4L。
(2)溶液中铜离子的物质的量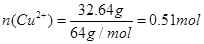 ,因此原硝酸的物质的量浓度
,因此原硝酸的物质的量浓度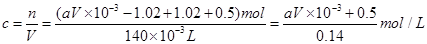
(3)发生的反应为2NO2+H2O2=2HNO3、2NO+3H2O2=2HNO3+2H2O。设与NO2反应的H2O2的质量为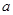 ,与NO反应的H2O2的质量为
,与NO反应的H2O2的质量为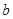 ,则可得如下关系式:
,则可得如下关系式: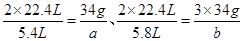 ,解得
,解得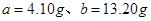 ,因此需要30%的双氧水的质量为
,因此需要30%的双氧水的质量为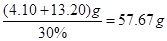 。
。
点评:本题考查了铜与硝酸反应中所涉及到的计算,属于基础题。解题的关键在于正确写出化学方程式,在计算的过程中应注意关系式法、守恒法的应用。
