某校化学小组学生利用如图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去)。
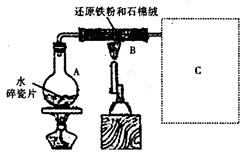
(1)装置B中发生反应的化学方程式是 。
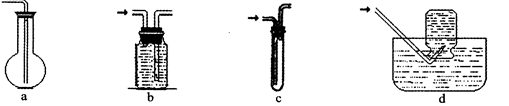
(2)虚线框图C的气体收集装置是下图中的 (选填字母编号)。
(3)反应停止,待B管冷却后,称量,得到固体质量为28.8g。再向固体中加入过量稀盐酸充分反应,并进行如下实验:

试剂a的化学式是 ,试剂b的化学式是 ;加入新制氯水后溶液红色加深的原因是(用离子方程式表示) 。
(4)某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现请对褪色原因进行探究。首先提出假设。假设1:溶液中的+3价铁被氧化为更高的价态;假设2:
;为了对所提出的假设2进行验证,实验方案是
。
(5)根据所给数据,可计算出反应后B装置中铁元素的质量分数为 。
(1)3Fe + 4H2O  Fe3O4 + 4H2↑ (1分)
Fe3O4 + 4H2↑ (1分)
(2)bd (2分)
(3)KSCN ,NaOH;2Fe2++Cl2→2Fe3++2Cl- (1分1格,共3分)
(4)SCN-被过量的氯水氧化;(2分)
取少量褪色后的溶液,滴加过量KSCN溶液,如果出现红色,则说明假设2 正确,若不变红,则假设2不正确。(2分)
(5)77.8% (2分)
题目分析:(2)氢气难溶于水,可用排水法收集。选bd。
(3)因为铁和水反应生成Fe3O4,Fe3O4,+8HCl=2FeCl3+FeCl2+4 H2O 。淡黄色溶液含少量Fe3+,加a:KSCN,Fe3++3SCN- =Fe(SCN)3 少量淡红色。加新制的氯水,把FeCl2氧化变成FeCl3和KSCN生成
Fe(SCN)3,再加NaOH,能生成Fe(OH)3 。加热Fe(OH)3变成红棕色的Fe2O3
(4)“SCN-被过量的氯水氧化”,为证明此假设,需加过量的KSCN溶液,看是否变红。
(5)解设原铁元素的质量为x
2Fe------- Fe2O3
2*56 160
x 32 x=22.4
Fe%=22.4*100%/28.8=77.8%
