某实验小组用工业废弃固体(主要成分为Cu2S和Fe2O3)制备有关物质,整个流程如下图所示。请回答:
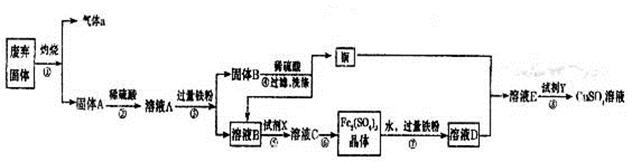
(1)气体a的化学式为 。
(2)溶液B加入硫酸酸化后再加入适宜氧化剂X得到溶液C,写出该反应的离子方程式 。
(3)制备硫酸铜溶液。常温下,O2、铜粉和稀硫酸三者在一起,几乎不反应,当加入溶液D后,随即生成硫酸铜。经理阅资料发现FeSO4对铜的氧化起催化作用。
A.第一步反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,则第二步反应的郭子方程式为 。
B.⑦操作中,配制Fe2(SO4)3溶液时应注意 。
(4)操作⑧的目的是得到较纯的硫酸铜溶液。加入适宜试剂Y调节pH至铁元素全部沉淀(离子浓度小于10-5mol/L),然后再过滤,浓缩、结晶等,则pH至少调节为_____。
已知:Ksp[Cu(OH)2]≈1×10-22,Ksp[Fe(OH)2] ≈1×10-16,Ksp[Fe(OH)3] ≈1×10-38
(5)科学家发现纳米级的Cu2O在太阳光照射下可以催化分解水。
A.一定温度下,在2L密闭容器中加入纳米级Cu2O,通入2mol水蒸气,发生如下反应:
2H2O(g)=2H2(g)+O2(g) △H=+484kJ/mol
20min末测得n(O2)=0.16mol,则这段时间的反应速率υ(H2)=_________;该温度下,此反应的平衡常数表达式K=___________________。
B.已知:2Cu2O(s)+O2(g)=4CuO(s) △H=-292kJ/mol
2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
请写出炭粉还原CuO(s)制备Cu2O(s)的热化学方程式_________________。
(除去注明外,每空2分,共14分)(1)SO2(1分)
(2)2Fe2++H2O2+2H+=2Fe3++2H2O或4Fe2++O2+4H+=4Fe3++2H2O
(3)2Fe3++Cu=2Fe2++Cu2+;向配制溶液中加入少量的硫酸防止水解或将Fe2(SO4)3溶解在稀硫酸中,再加水稀释 (4)3 (5)0.008mol/(L·min)(单位占1分);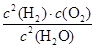 (1分);
(1分);
2CuO(s)+C(s)=CO(g)+Cu2O(s) △H=+35.5 kJ/mol
题目分析:(1)Cu2S灼烧生成SO2和铜,反应的化学方程式是Cu2S+O2 2Cu+SO2↑,因此气体a是SO2。
2Cu+SO2↑,因此气体a是SO2。
(2)固体A是氧化铁和铜的混合物,加入稀硫酸固体溶解生成硫酸铁,进而硫酸铁又溶解铜,所以溶液A是硫酸铁、硫酸亚铁、硫酸铜以及硫酸的混合液。加入过量的铁粉后生成硫酸亚铁和铜,所以固体B是铜和铁的混合物,溶液B是硫酸亚铁。要得到硫酸铁晶体,则需要将硫酸亚铁氧化生成硫酸铁,因此氧化剂X可以是双氧水或氧气,有关的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O或4Fe2++O2+4H+=4Fe3++2H2O。
(3)由于铁离子具有氧化性,能把铜氧化生成铜离子,而铁离子又被还原生成亚铁离子,因此第二步反应的离子方程式是2Fe3++Cu=2Fe2++Cu2+;由于铁离子易水解生成氢氧化铁,所以配制硫酸铁溶液时,要防止铁离子水解,因此正确的操作应该是向配制溶液中加入少量的硫酸防止水解或将Fe2(SO4)3溶解在稀硫酸中,再加水稀释。
(4)溶液E是硫酸铜和硫酸亚铁的混合液,根据溶度积常数可知,要得到硫酸铜溶液,需要除去亚铁离子。由于氢氧化亚铁的溶度积常数大于氢氧化铜的,但氢氧化铁的溶度积常数小于氢氧化铜的,所以应该加入氧化剂将亚铁离子氧化成铁离子。根据氢氧化铁的溶度积常数可知,要调节pH至铁元素全部沉淀(离子浓度小于10-5mol/L),溶液中的OH-应该为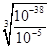 =10-11mol/L,所以pH至少调节为3。
=10-11mol/L,所以pH至少调节为3。
(5)20min末测得n(O2)=0.16mol,则根据方程式可知,生成氢气是0.16mol×2=0.32mol,其浓度是0.32mol÷2L=0.16mol/L,因此氢气的反应速率υ(H2)=0.16mol/L÷20min=0.008mol/(L·min)。化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此根据方程式可知该温度下,此反应的平衡常数表达式K=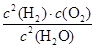 ;根据反应①:2Cu2O(s)+O2(g)=4CuO(s) △H=-292kJ/mol和反应②:2C(s)+O2(g)=2CO(g) △H=-221kJ/mol并依据盖斯定律可知,(②-①)÷2即得到反应2CuO(s)+C(s)=CO(g)+Cu2O(s),所以该反应的反应热△H=(-221kJ/mol+292kJ/mol)÷2=+35.5 kJ/mol。
;根据反应①:2Cu2O(s)+O2(g)=4CuO(s) △H=-292kJ/mol和反应②:2C(s)+O2(g)=2CO(g) △H=-221kJ/mol并依据盖斯定律可知,(②-①)÷2即得到反应2CuO(s)+C(s)=CO(g)+Cu2O(s),所以该反应的反应热△H=(-221kJ/mol+292kJ/mol)÷2=+35.5 kJ/mol。
