问题
选择题
将1.92g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到672ml气体(标准状况),将盛有此气体的容器倒扣在水中,通入少量氧气,最后剩余气体224ml(标准状况)。则通入的氧气在标准状况下的体积为
A.504ml
B.168ml
C.336ml
D.224ml
答案
答案:B
题目分析:672ml气体应该是NO2和NO的混合物,物质的量是0.672L÷22.4L/mol=0.03mol。通入氧气后剩余的气体一定是NO,物质的量是0.01mol。1.92g铜在反应中共失去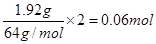 电子,则根据电子的得失守恒可知,消耗氧气的物质的量是
电子,则根据电子的得失守恒可知,消耗氧气的物质的量是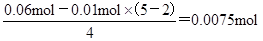 ,在标准状况下的体积是0.0075mol×22.4L/mol=0.168L=168ml,答案选B。
,在标准状况下的体积是0.0075mol×22.4L/mol=0.168L=168ml,答案选B。
点评:该题是中等难度的试题,也是高考中的常见题型和重要的考点。试题基础性强,注重解题的灵活性,有利于培养学生的逻辑思维能力和创新思维能力。该题的关键是在明确反应原理的基础上灵活运用电子得失守恒。
