下图文并茂为浓盐酸的试剂瓶包装标签上部分文字,请仔细阅读回答问题:

(1)欲配制200g10%的稀盐酸需用(填仪器名)______取______ml上述浓盐酸.
(2)查阅资料:MnO2与溶质质量分数大于12%的盐酸在加热时反应可以制备氯气,同时生成二氯化锰和水,该反应的方程式______.
①若要用浓盐酸足量MO制取7.1g氯气,所取浓盐酸的体积______ml.
②制备氯气时的气体发生装置可以选择下列装置中的(填序号)______.
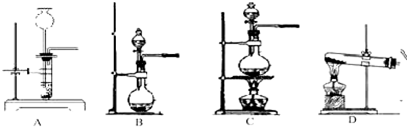
③利用上图中的装置B使浓盐酸与浓硫酸混合可以制备氯化氢气体,其原因是______.
(1)设需要浓盐酸的体积为X则:X×36%═200g×10%,解得X=47.1mL,所以所用量筒为50mL;反应物是MnO2与盐酸生成物是氯气、二氯化锰和水,用观察法配平即可;
(2)设要制取7.1g氯气,需要氯化氢质量为Y则:
MnO2+4HCl=MnCl2+Cl2+2H2O
146 71
Y 7.1g
根据:
=146 71
解得Y=14.6g,则浓盐酸的质量为:Y 7.1g
=40.56,则体积为14.6g 36%
=34.4mL,因为浓盐酸具有挥发性,所以需要的浓盐酸要大于34.4mL40.56g 1.18g/mL
由于反应物是固体和液体,还需要加热,所以只有C符合这一反应所需要的条件;浓盐酸与浓硫酸混合可以制备氯化氢气体主要是因为浓硫酸具有吸水性,使盐酸变为浓盐酸,而浓盐酸具有挥发性,所以能得到氯化氢气体.
故答案为:(1)50ml量筒;47.1;MnO2+4HCl
MnCl2+Cl2↑+2H2O;(2)大于34.4;C;浓硫酸吸水,浓盐酸易挥发. △ .
