铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
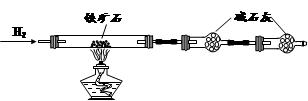
A B C
Ⅰ.铁矿石中含氧量的测定
① 按上图组装仪器,检查装置的气密性;
② 将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③ 从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯
④ 充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为 。
(2)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为 。
Ⅱ.铁矿石中含铁量的测定
(1)步骤④中煮沸的作用是 。
(2)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、 。
(3)下列有关步骤⑥的操作中说法正确的是 。
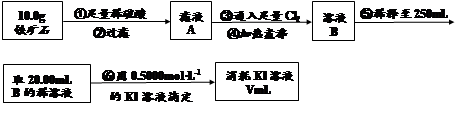
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测液润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色再读数
(4)若滴定过程中消耗0.5000mol·L−1KI溶液20.00mL,则铁矿石中铁的百分含量为 。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为 。
(14分)
Ⅰ.(1)防止空气中的水蒸气和CO2进入B中,影响测定结果。(2分)
(2)24% (2分)
Ⅱ.(1)赶走溶液中溶解的过量的Cl2 (2分)
(2)250mL容量瓶 (2分)(未答“250mL”不给分)
(3)df (2分) (4)70% (2分)Ⅲ. Fe5O6 (2分)
题目分析:
Ⅰ.(1)B中的碱石灰是吸收置换反应生成的水的,为了防止空气成分对实验的影响,要加一个装置吸收空气中的水以及二氧化碳;
(2)氧元素的百分含量为: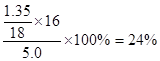
Ⅱ.(1)通入过量的Cl2是为了将铁元素全部变为Fe3+,但是为了防止过量的氯气与KI反应,使测定结果偏高,所以要将溶液煮沸赶走溶液中溶解的过量的Cl2。
(2)步骤⑤是溶液的配制(稀释),可知该处应该用250ml的容量瓶。
(3)a.碘水、Fe3+均为黄色,滴定过程中颜色无明显变化,故a错。
b.2Fe3+ + 2I− = 2Fe2+ + I2,滴定一开始就生成I2,使淀粉溶液变蓝,无法指示终点。正确的指示剂应该为KSCN,颜色变化为血红色变为无色。故b错。
c.滴定管用蒸馏水洗涤后必需用待装液润洗后才能装液。故c错。
e.滴定时,左手控制滴定管,右手摇动锥形瓶。故e错。
f.滴定过程中,眼睛注视锥形瓶中溶液颜色变化。故f错。
(4)由于所取溶液(含Fe3+)的体积与消耗KI溶液的体积相等,结合方程式可知,c(Fe3+)=c(KI)=0.5mol·L−1,所以铁元素的百分含量为: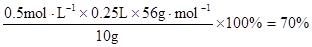
Ⅲ.因为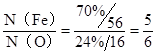 ,所以铁矿石中铁的氧化物的化学式为Fe5O6
,所以铁矿石中铁的氧化物的化学式为Fe5O6
考点定位:本题是一道探究铁的氧化物和氢氧化物、测量物质的含量知识的一道综合考查题,考查学生分析和解决问题的能力,综合性强,难度大.
