某小组同学设计实验探究Fe3+与Fe2+相互转化,实验方案及现象如下:
Ⅰ. 配制FeCl2溶液
取部分变质的氯化亚铁固体[含有难溶性杂质Fe(OH)2Cl],向其中加入稀盐酸,使其完全溶解,再加入适量铁粉。
Ⅱ. 实验探究Fe3+与Fe2+相互转化
实验1:
0.1 mol/L FeCl2溶液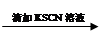 无明显现象
无明显现象 溶液变红
溶液变红
实验2:
0.1 mol/L FeCl3溶液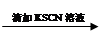 溶液变红
溶液变红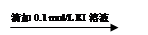 溶液红色未褪去
溶液红色未褪去
写出Fe(OH)2Cl与盐酸反应的离子方程式 。
(2)请用离子方程式解释实验1中滴加氯水后溶液变红的原因 。
(3)实验2的现象与预测不同, 为探究可能的原因,该小组同学又进行了如下实验,方案及现象如下:
步骤1:10 mL 0.1 mol/L KI溶液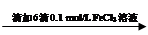 溶液明显变黄
溶液明显变黄
步骤2:将黄色溶液分为三份:
试管1 取2 mL黄色溶液 溶液变红
溶液变红
试管2 取3 mL黄色溶液 溶液变蓝
溶液变蓝
试管3 取3 mL黄色溶液 取上层溶液
取上层溶液 溶液变蓝(比试管2中溶液颜色深)
溶液变蓝(比试管2中溶液颜色深)
① 试管2中滴加K3[Fe(CN)6]检验的离子是 。
② 黄色溶液中含有的溶质微粒有K+、Cl-和 。
③ 综合上述实验现象,得出的实验结论是 。
(1)Fe(OH)2Cl + 2H+ = Fe3+ + Cl- + 2H2O(1分)
(2)2Fe2+ + Cl2 = 2Cl- + 2Fe3+(1分)
(3)①Fe2+(1分) ②Fe3+、Fe2+、I2 (2分) ③Fe3+与I-的反应为可逆反应(2分)
题目分析:
(1)根据题意可得:Fe(OH)2Cl + 2H+ = Fe3+ + Cl- + 2H2O
(2)Cl2 与Fe2+发生氧化还原反应:2Fe2+ + Cl2 = 2Cl- + 2Fe3+(1分)
(3)①K3[Fe(CN)6]专门用于检验的Fe2+试剂; ②滴加KSCN溶液溶液变红有Fe3+、加2滴K3[Fe(CN)6]溶液溶液变蓝有Fe2+、滴加6滴0.1 mol/L FeCl3溶液溶液明显变黄有I2 ;③反应物、生成物都存在,试管3中实验说明平衡移动,则Fe3+与I-的反应必为可逆反应。
