某同学将一定量铁粉与Cl2恰好完全反应得到一固体物质R,然后通过实验确定其成分。探究过程如下:
(1)提出假设:(请把下列假设补充完整)
假设A:该固体物质是FeCl3;
假设B:__________________________________________________________;
假设C:__________________________________________________________。
(2)设计实验方案:
取少量固体物质R于烧杯中,加适量水溶解,然后取两份R溶液分别进行实验,实验现象与结论如下表,请在表格内填写实验现象:
| 实验方法 | 实验现象 | 结论 |
| ①向R溶液中 加KSCN溶液 | 固体物质中有FeCl3 | |
| ②向R溶液中滴加 酸性KMnO4溶液 | 固体物质中不含FeCl2 |
由此得出结论:假设________成立(填字母)。
(3)写出向R溶液中滴加少量KSCN溶液的离子方程式: 。25°C时,测得该反应达平衡时的平衡常数为K1,保持温度不变,继续滴加少量KSCN溶液,达新平衡时,测得平衡常数为K2,则K1 K2(填“>”,“<”或“=”),溶液的颜色 (填“变深”,“变浅”或“不变”)。
(4)R溶液常作印刷电路铜板的腐蚀剂,写出该反应的离子方程式:___________________________。
(9分,每空1分)
(1)该固体物质是FeCl2; 该固体物质是FeCl3和FeCl2的混合物;(两空答案可相互交换)
(2)①溶液为血红色; ②KMnO4溶液紫色不褪色; A;
(3)Fe3++3SCN- Fe(SCN)3; =; 变深 ; (4)2Fe3++Cu = 2Fe2++Cu 2+
Fe(SCN)3; =; 变深 ; (4)2Fe3++Cu = 2Fe2++Cu 2+
题目分析:(1)根据类比法,结合假设A可知,产物可能为FeCl2、FeCl3或FeCl3和FeCl2的混合物,即假设B是该固体物质是FeCl2;假设C是该固体物质是FeCl3和FeCl2的混合物。
(2)铁离子能和KSCN溶液反应使溶液显红色,因此固体物质中有FeCl3,在溶液中加入KSCN溶液,溶液应变红;亚铁离子具有还原性,能使酸性高锰酸钾溶液褪色,因此在酸性KMnO4溶液中加入少量固体R,KMnO4溶液颜色无明显变化,说明固体中不含还原性物质,即不含FeCl2,由此得出固体R是由氯化铁构成的,即假设A正确。
(3)氯化铁与KSC溶液反应的离子方程式为Fe3++3SCN- Fe(SCN)3;保持温度不变,继续滴加少量KSCN溶液,增大KSCN的浓度,平衡向正反应方向移动,因此溶液的红色加深。由于平衡常数只与温度有关系,所以K1=K2。
Fe(SCN)3;保持温度不变,继续滴加少量KSCN溶液,增大KSCN的浓度,平衡向正反应方向移动,因此溶液的红色加深。由于平衡常数只与温度有关系,所以K1=K2。
(4)铁离子具有氧化性,能把单质铜氧化生成铜离子,反应的离子方程式为2Fe3++Cu = 2Fe2++Cu 2+。

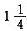 分钟遇到丙。再过
分钟遇到丙。再过 分钟第二次遇到乙。已知乙的速度是甲的
分钟第二次遇到乙。已知乙的速度是甲的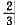 ,湖的周长为600米。则丙的速度为()。
,湖的周长为600米。则丙的速度为()。