三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校化学实验小组通过实验探究某红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4。
设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
(1)若只有Fe2O3,则实验现象是_____________。
(2)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则此过程中的离子反应为:
____________________________。
(3)经实验分析,确定红色粉末为Cu2O和Fe2O3的混合物。实验小组欲测定Cu2O的质量分数。已知Cu2O在空气中加热生成CuO。
测定流程:
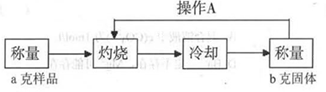
实验中操作A的名称为_____________。
灼烧过程中,所需仪器有:酒精灯、玻璃棒、_____________等(夹持仪器除外)。
(4)写出混合物中Cu2O的质量分数的表达式_____________。
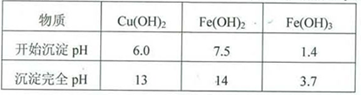
实验小组欲利用红色粉末制取较纯净的胆矾(CuSO4•5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
实验室有下列试剂可供选择:
A.氯水
B.H2O2
C.NaOH
D.Cu2(OH)2CO3实验小组设计如下实验方案制取胆矾:
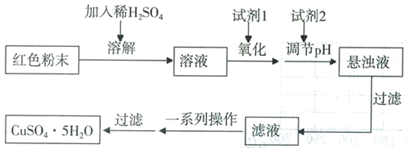
(5)用试剂编号表示:试剂l为_____________,试剂2为_____________。
(6)为什么先“氧化”后“调节pH”?pH控制范围为多少?__________________________________
(本题共12分)(1)固体完全溶解,溶液呈血红色(1分)
(2)Fe2O3 +6H+→2Fe3++3H2O、Cu2O+2H+→Cu+Cu2++ H2O、2Fe3++Cu→2Fe2++Cu2+(3分)
(3)恒重操作、坩埚(2分)
(4)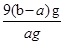 或
或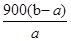 %(2分)
%(2分)
(5)试剂1为B,试剂2为D。(2分)
(6)由于亚铁离子和铜离子开始沉淀、沉淀完全的pH值很接近,难以分离,把亚铁离子氧化为铁离子,pH控制范围:3.7<pH<6将铁离子转化为沉淀而被除去。(2分)
题目分析:(1)若红色粉末是Fe2O3,Fe2O3与硫酸反应生成硫酸铁,没有红色不溶物,滴加KSCN溶液,溶液变为红色,因此实验现象是固体完全溶解,溶液呈血红色。
(2)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,这说明反应中没有铁离子生成,而是生成亚铁离子,因此固体粉末是Fe2O3和Cu2O的混合物,放入足量稀硫酸中会有Cu生成,Cu能将Fe3+还原为Fe2+,有关反应的离子方程式是Fe2O3 +6H+→2Fe3++3H2O、Cu2O+2H+→Cu+Cu2++ H2O、2Fe3++Cu→2Fe2++Cu2+。
(3)为使固体完全反应,需要进行恒重操作,即操作A是恒重操作。固体灼烧需要在坩埚中完成,因此还需要的仪器是坩埚。
(4)根据方程式2Cu2O+O2=4CuO可知,固体增加的质量就是参加反应的氧气德文质量,则
Cu2O~~~2CuO 质量增重△m
144g 16g
m(Cu2O) (b-a)g
解得m(Cu2O)=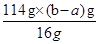 =9(b-a)g
=9(b-a)g
故混合物中Cu2O的质量分数为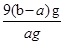 ×100%=
×100%=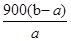 %
%
(5)红色粉末为Fe2O3和Cu2O的混合物,由工艺流程可知,放入足量稀硫酸中会有Cu生成,Cu能将Fe3+还原为Fe2+,所得的溶液含有Fe2+,加入试剂1目的是Fe2+将为Fe3+,氯气会引入氯离子,故试剂1应选择绿色氧化剂双氧水,即答案选B;加入试剂2目的是调节溶液的pH值使Fe3+转化为Fe(OH)3沉淀除去,过滤得到硫酸铜溶液,氢氧化钠会引入钠离子,故试剂2应选择Cu2(OH)2CO3,得到的沉淀x为Fe Fe(OH)3。
(6)根据表中数据可知,由于亚铁离子和铜离子开始沉淀、沉淀完全的pH值很接近,难以分离,所以必须把亚铁离子氧化为铁离子,pH控制范围:3.7<pH<6将铁离子转化为沉淀而被除去。
