重晶石矿(主要成分为硫酸钡)因为含有Fe2O3、MnO及炭质等杂质而常呈深褐色。工业上将重晶石矿粉碎后与硫酸、铝粉在反应槽中混合加热(即“漂白”),再经水洗等一系列工序制得白色的重晶石填料,广泛用作纸张、油漆等的填充剂。已知MnO是碱性氧化物,Al粉可以将深色的Fe3+转化为浅色的Fe2+。
重晶石填料的生产工艺流程为:
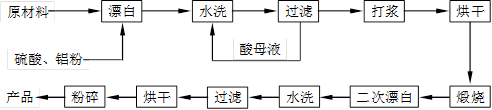
(1)在该流程中,为加快“漂白”速度,采取的措施有 、
。
(2)硫酸起到了“漂白”的作用。请写出硫酸直接起到该作用时的化学方程式:
、 。
(3)二次漂白水洗过滤后,检验滤渣不含Fe2+离子的方法是
、 。
(4)二次漂白前,煅烧的主要目的是 。将煅烧后的固体磨成细粉,使用的是加有刚玉球的振动磨。这说明刚玉具有很高的 。
(5)工业生产中为了充分利用资源,将滤液经过处理得到化工原料Fe2O3。操作过程是:
①滤液中通入过量Cl2,其目的是 。
②再加入适量NaOH来调节溶液的pH ,其目的是 ,调节溶液的pH范围为 。
有关离子开始沉淀及完全沉淀时的pH如下:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
(6)最后通过 、 得到氧化铁。
(1)重晶石和铝都使用粉末(1分);加热(1分)。
(2)Fe2O3+3H2SO4→ Fe2(SO4)3+3H2O(1分) MnO+H2SO4→MnSO4+H2O(1分)
(3)取最后一次洗涤液于试管中,先滴加氯水再滴加KSCN溶液无明显变化。(1分)
(4)除去炭质(1分); 硬度(1分)。
(5)①将Fe2+转化为Fe3+ (1分)②使Fe3+ 沉淀完全,而其它离子不发生沉淀(1分)3.7—3.8 (1分)
(6)过滤、洗涤(1分);灼烧(1分)
题目分析:
(1)重晶石和铝都使用粉末,增大表面积、加热都可加快速率。
(2)根据框图信息知:Fe2O3+3H2SO4→ Fe2(SO4)3+3H2O、 MnO+H2SO4→MnSO4+H2O。
(3)检验滤渣不含Fe2+离子的方法是取最后一次洗涤液于试管中,先滴加氯水再滴加KSCN溶液无明显变化。
(4)结合题意可知作用为除去炭质;刚玉的硬度很大。
(5)①滤液中通入过量Cl2将Fe2+完全转化为Fe3+ ,②使Fe3+ 沉淀完全,而其它离子不发生沉淀,结合表格中数据可知调节溶液的pH范围3.7—3.8即可。
(6)分离固体和液体,经过过滤、洗涤;灼烧即可。
